
| A.一样多 | B.前者较后者多 |
| C.后者较前者多 | D.无法比较 |
| ||
| ||


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙,由橙变黄 | D.甲基橙、由黄变橙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
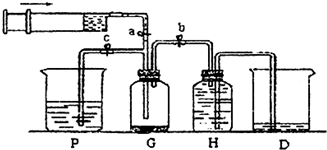
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.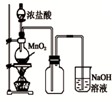 如图中:即使MnO2过量,盐酸也不能全部消耗 |
B. 如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
C.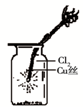 如图中:生成棕色的烟 |
D.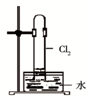 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验正确的操作是先挤压出胶头滴管中的水,再打开止水夹 |
| B.该实验说明氨气是一种极易溶于水的气体,且氨水有碱性 |
| C.将烧瓶中形成的溶液加热,不会发生现象改变 |
| D.形成“喷泉”的原因是氨气溶于水后,烧瓶内的气压小于大气压 |
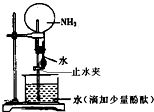
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
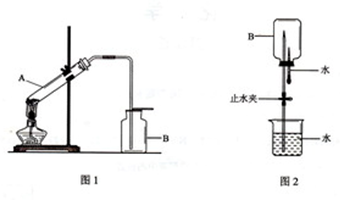
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
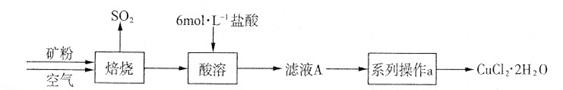

 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。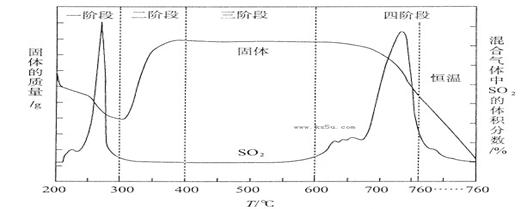

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com