
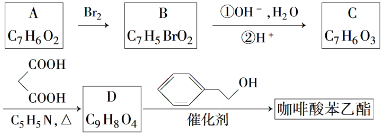
 ;
; ;
; .a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①
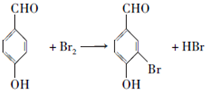
.a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应① 分析 A的核磁共振氢谱(${\;}_{\;}^{1}$H-NMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显示反应,说明A中含有酚羟基,根据A的分子式可知,A为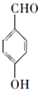 ,根据B的分子式可知,A发生取代反应生成B为
,根据B的分子式可知,A发生取代反应生成B为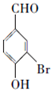 ,B在碱性条件下水解再酸化得C为
,B在碱性条件下水解再酸化得C为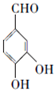 ,根据D的分子式可知,C与丙二酸反应生成D为
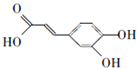
,根据D的分子式可知,C与丙二酸反应生成D为 ,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为
,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为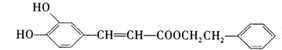 ,据此答题.
,据此答题.
解答 解:A的核磁共振氢谱(${\;}_{\;}^{1}$H-NMR)显示,分子中有4种不同化学环境的氢原子,A能与FeCl3溶液发生显示反应,说明A中含有酚羟基,根据A的分子式可知,A为 ,根据B的分子式可知,A发生取代反应生成B为
,根据B的分子式可知,A发生取代反应生成B为 ,B在碱性条件下水解再酸化得C为
,B在碱性条件下水解再酸化得C为 ,根据D的分子式可知,C与丙二酸反应生成D为
,根据D的分子式可知,C与丙二酸反应生成D为 ,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为
,D与苯乙醇发生酯化反应生成咖啡酸苯乙酯为 ,
,
(1)丙二酸的结构简式为HOOCCH2COOH,
故答案为:HOOCCH2COOH;
(2)咖啡酸苯乙酯为 ,咖啡酸苯乙酯含有的官能团名称为 酯基、碳碳双键、羟基,
,咖啡酸苯乙酯含有的官能团名称为 酯基、碳碳双键、羟基,
故答案为:酯基、碳碳双键、羟基;
(3)根据咖啡酸苯乙酯的结构简式可知,其分子式为C17H16O4,D的结构简式为 ,
,
故答案为:C17H16O4; ;
;
(4)根据上面的分析可知,B→C反应类型为取代反应、中和反应,
故答案为:取代反应、中和反应;
(5)A→B的化学方程式为 ,
,
故答案为: ;
;
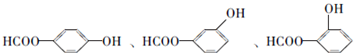
(6)C为 ,根据条件a.属于酯类,说明有酯基,b.能发生银镜反应,说明有醛基,c.与FeCl3溶液发生显色反应,说明有酚羟基,则符合条件的同分异构体的结构简式为:
,根据条件a.属于酯类,说明有酯基,b.能发生银镜反应,说明有醛基,c.与FeCl3溶液发生显色反应,说明有酚羟基,则符合条件的同分异构体的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,注意根据有机物分子式、反应条件以及题目给予的反应信息进行推断,熟练有机物官能团性质与转化是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气所含的分子数为NA | |
| B. | 1.8 g 的NH4+中含有的电子数为NA | |
| C. | 常温常压下,48 g O3含有的氧原子数为NA | |
| D. | 24 g金属镁变为镁离子时失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | CH3CH2OH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 分解反应和复分解反应都不是氧化还原反应 | |
| C. | 氧化还原反应中一定有电子发生转移 | |
| D. | 置换反应也有可能是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
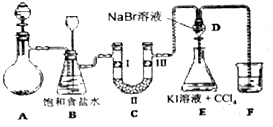
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com