
【题目】【化学—选修3:物质结构与性质】
Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的_________区,其基态原子有_________种能量不同的电子。
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种);NH3分子的VSEPR模型为_______________。
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。其晶体类型为___________。晶体中σ键和π键的数目之比为_________。
(4)Ni可作为 或
或![]() 与H2加成的催化剂。在相同压强下,
与H2加成的催化剂。在相同压强下, 的沸点比
的沸点比![]() 低,原因为_________________。
低,原因为_________________。
(5)  有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);氧原子的杂化轨道类型为______________。
(6)已知:钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分別为a nm、bnm,阿伏加德罗常数的值为NA。则该晶体的密度为________g /cm3(列出计算式即可)。

【答案】 ds 7 CCl4、SiCl4、CBr4、SiF4等合理答案即可 四面体形 分子晶体 1:1  形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键 H<C<N<O sp3
形成分子间氢键 H<C<N<O sp3 ![]()
【解析】(1)区的名称来自于按照工作原理最后填入电子轨道的名称,因此Cu元素位于元素周期表的ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1,因此有7种能量不同的电子。(2)原子数和价电子数分别都相等的是等电子体,则与SO42-互为等电子体的分子的化学式为CCl4、SiCl4、CBr4、SiF4等;NH3分子中氮原子的价层电子对数=3+(5-3×1)/2=4,所以VSEPR模型为四面体形。(3)Ni(CO)4的熔点为-25℃,沸点为43℃,这说明晶体类型为分子晶体。单键都是σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键,晶体中σ键和π键的数目之比为8:8= 1:1。(4) 形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键,分子间氢键大于分子内氢键,因此在相同压强下,
形成分子间氢键,分子间氢键大于分子内氢键,因此在相同压强下, 的沸点比
的沸点比![]() 低。(5) 非金属性越强,电负性越大,则其中所含非金属元素的电负性由小到大的顺序为H<C<N<O;氧原子的价层电子对数是4,杂化轨道类型为sp3。(6)Y位于体心,数目为1,Ba位于体心,数目为2,Cu位于顶点和棱心,数目为8×1/8+8×1/4=3,O位于棱心和面心,数目为12×1/4+8×1/2=7,化学式为YBa2Cu3O7,则该晶体的密度为
低。(5) 非金属性越强,电负性越大,则其中所含非金属元素的电负性由小到大的顺序为H<C<N<O;氧原子的价层电子对数是4,杂化轨道类型为sp3。(6)Y位于体心,数目为1,Ba位于体心,数目为2,Cu位于顶点和棱心,数目为8×1/8+8×1/4=3,O位于棱心和面心,数目为12×1/4+8×1/2=7,化学式为YBa2Cu3O7,则该晶体的密度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ/mol;
2CO2(g) ΔH=566 kJ/mol;
②Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ/mol
O2(g) ΔH=226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)![]() 2Na2CO3(s)+O2(g) ΔH>452 kJ/mol
2Na2CO3(s)+O2(g) ΔH>452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ 热量时,转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2FeCl3+2KI![]() 2FeCl2+2KCl+I2 ②KClO3+6HCl
2FeCl2+2KCl+I2 ②KClO3+6HCl![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
③2FeCl2+Cl2![]() 2FeCl3 ,下列物质的氧化能力强弱顺序正确的是
2FeCl3 ,下列物质的氧化能力强弱顺序正确的是
A.FeCl3>Cl2>I2> KClO3 B.KClO3>Cl2> FeCl3>I2
C.Cl2>KClO3> FeCl3>I2 D.KClO3>Cl2>I2> FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.0 g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气8.96 L,则混合物中Fe与Al的物质的量之比( )
A. 1:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al → Al2O3 → Al(OH)3 → NaAlO2
B. Si → SiO2 → H2SiO3 →Na2SiO3
C. N2 → NO → NO2 → HNO3
D. S → SO3 → H2SO4 → MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于现在的元素周期表的说法中正确的是( )
A. 从左向右数第六纵行是ⅥA族
B. 所含元素形成的化合物种类最多的族是第IVA族
C. 七个周期18个族
D. ⅠA族全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种常见的滴定剂和重要化工原料。实验室制备硫代硫酸钠的流程如下:

回答下列问题:
(1)“溶解”使用的水必须先煮沸一段时间,然后冷却至室温待用。其目的是____________。
(2)“反应”中的化学方程式为_____________________________________________。
(3)设计如图所示装置制备硫代硫酸钠晶体:

①B瓶的作用是___________________。
②实验中先打开________(填“A”或“C”)处分液漏斗的活塞。.
③装置D用于处理尾气,可选用的最合理装置为______________(填标号)。

(4)为了探究粗产品中的杂质,进行如下假设并进行实验:
①该粗产品中可能含有的杂质是Na2CO3、NaHCO3、Na2SO3、NaHSO3、S、Na2S和_____________
等其中的一种或几种。
②取少量产品于试管,加入足量稀硫酸,将气体通入CuSO4溶液中,未产生黑色沉淀。据此,______(填“能”,或“不能”)认为粗产品中一定没有Na2S,理由是 _____________________________。
③请选择下列试剂设计实验方案,检验产品中含有Na2CO3或NaHCO3。
限选试剂:3 molL-1H2SO4溶液、1 mol L-1 NaOH溶液、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水。
实验方案 | _______. |
实验现象 | _______. |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
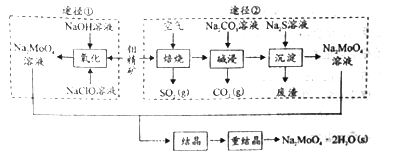
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是____________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有__________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)。
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入 Ba(OH)2固体引起溶液体积变化可忽略]。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com