

分析 (1)工业上用N2和H2在催化剂的作用高温加热合成氨气;
(2)工业制硝酸是在接触室内将氨气催化氧化成NO;
(3)实验利用消石灰和NH4Cl固体混合加热制氨气,同时生成氯化钙和水.
解答 (1)利用N2和H2合成氨气的反应方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(2)工业上用氨气的催化氧化制取NO,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)实验室利用消石灰和氯化铵混合加热制氨气的反应方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:氢氧化钙(或消石灰);Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑.
点评 本题注重基础知识的考查,难度较低.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
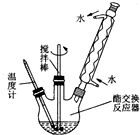 为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:
为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- | |
| B. | 加HCl酸化的BaCl2有白色沉淀,一定有SO42- | |
| C. | 滴加硝酸酸化的AgNO3溶液没有白色沉淀,一定没有SO42- | |
| D. | 滴加BaCl2有白色沉淀,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度 | B. | 加入几滴硫酸铜溶液 | ||
| C. | 再加入少量浓硝酸 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com