
ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。
2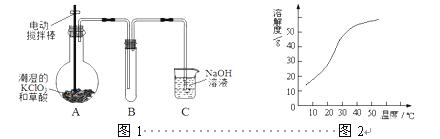
(1)A装置电动搅拌棒的作用是 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;(2)NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知2 Na2S2O3 + I2 =Na2S4O6 + 2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
②滴定过程中进行三次平行测定的原因是 。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 。(填“偏高”、“偏低”或“不变” )
【知识点】溶液配制 滴定误差分析A3 H2
【答案解析】(1)反应时搅拌,增大反应物的接触面积,加快反应速率
温度计 (2) 使ClO2充分冷凝,减少挥发
(3)②趁热过滤 ③用38℃~60℃热水洗涤
(4)① 100 mL 容量瓶、胶头滴管 ②取平均值,减少计算误差 ③偏高 (每空2分)
解析:(1)A装置电动搅拌棒的作用是搅拌,增大反应物的接触面积,加快反应速率;要控制温度必须使用温度计测量温度,(2)二氧化氯的熔点较低,使ClO2充分冷凝,减少挥发,所以使用冰水浴;
(3)②从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,③用38℃~60℃热水洗涤 ;
(4)① 配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:100 mL 容量瓶、胶头滴管;②为减少实验误差,应采用多次实验的方法;③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,读取Na2S2O3标准溶液的体积偏大,导致测定所得溶液中ClO2的含量偏高。
【思路点拨】本题考查了溶液配制,滴定误差分析等基本试验常识,比较基础。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)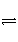
 1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO )>c(NH
)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图表示的一些物质或概念间的从属关系中不正确的是( )
| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
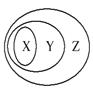
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:反应①Fes)+CO2g)FeOs)+COg)的平衡常数为K1;反应②Fes)+H2Og)FeOs)+H2g)的平衡常数为K2,不同温度下K1、K2的值如表中所示:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1 173 K | 2.15 | 1.67 |
请回答下列问题:
1)从表中数据可以推断:反应①是________填“吸”或“放”)热反应。
2)现有反应CO2g)+H2g)COg)+H2Og),写出该反应的平衡常数K3的数学表达式:________。
3)根据反应①与②,可推导出K1、K2与K3之间的关系式。据此关系式及表中数据,也能推断出反应③是吸热反应还是放热反应。欲使反应③在一定条件下建立的平衡向正反应方向移动,可采用的措施有________填序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
甲醇脱水反应
2CH3OHg)===CH3OCH3g)+H2Og)ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OHg)===C2H4g)+2H2Og)ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OHg)===CH3OCH3g)ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4g)+H2Og)===C2H5OHg)的ΔH=________kJ·mol-1。
2)[2012·广东理综,314)]碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Lis)+I2s)===2Lis) ΔH
已知:4Lis)+O2g)===2Li2Os) ΔH1
4LiIs)+O2g)===2I2s)+2Li2Os) ΔH2
则电池反应的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,A池用石墨电极电解pH=13氢氧化钠溶液(100 mL),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、Ag),溶液是足量CuSO4溶液,通电一段时间后停止,A池a极产生的气体在标准状况下为2.24 L,则下列说法正确的是(双选)( )。

A.d电极质量一定减少6.4 g
B.c电极质量一定增加6.4 g
C.A池pH增大
D.A池溶液质量减少3.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用赤铁矿生产铁,可以选择的还原剂有C和H2。根据所学的知识判断:哪一种还原剂可使反应自发进行的温度较低?
已知:Fe2O3(s)+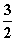 C(s)===2Fe(s)+
C(s)===2Fe(s)+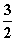 CO2(g)
CO2(g)
ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1
Fe2O3(s)+3H2(g)===2Fe(s)+3H2O(g)
ΔH=98 kJ·mol-1,ΔS=0.144 2 kJ·mol-1·K-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com