
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
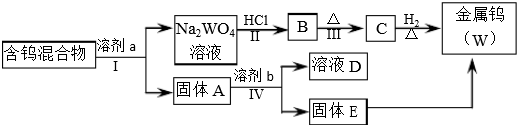
分析 步骤Ⅰ是将WO3分离出来,步骤Ⅳ可将W2O5分离出来,根据钨化合物在不同溶剂中的浸取率可知,试剂a应为饱和Na2C2O4(在CO2气氛下浸取),金属钨(W)、WO2、WO3、W2O5的混合物中WO3溶解生成Na2WO4,与酸反应得B为H2WO4,B受热分解得C为WO3,C被还原得W,固体A应为W、WO2、W2O5的混合物,W2O5在50g/L Na2CO3溶液中的浸取率为100%,所以将固体A用50g/L Na2CO3溶液浸取,W2O5溶于Na2CO3溶液,并能被空气中氧气氧化得D溶液应为Na2WO4溶液,过滤得到固体E为金属钨(W)、WO2的混合物,E被还原得到W,据此答题.
解答 解:步骤Ⅰ是将WO3分离出来,步骤Ⅳ可将W2O5分离出来,根据钨化合物在不同溶剂中的浸取率可知,试剂a应为饱和Na2C2O4(在CO2气氛下浸取),金属钨(W)、WO2、WO3、W2O5的混合物中WO3溶解生成Na2WO4,与酸反应得B为H2WO4,B受热分解得C为WO3,C被还原得W,固体A应为W、WO2、W2O5的混合物,W2O5在50g/L Na2CO3溶液中的浸取率为100%,所以将固体A用50g/L Na2CO3溶液浸取,W2O5溶于Na2CO3溶液,并能被空气中氧气氧化得D溶液应为Na2WO4溶液,过滤得到固体E为金属钨(W)、WO2的混合物,E被还原得到W,
(1)步骤Ⅰ和Ⅳ均要分离固体和液体,所以用到的操作为过滤,
故答案为:过滤;
(2)步骤Ⅱ为与酸反应生成钨酸,反应方程式为Na2WO4+2HCl=H2WO4+2NaCl,Ⅲ反应为钨酸受热分解,反应的化学方程式为H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O,
故答案为:Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O;
(3)WO3既属于金属氧化物,能与氢氧化钠反应,所以也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O,
故答案为:酸性;WO3+2OH-=WO42-+H2O;
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是饱和Na2C2O4(在CO2气氛下浸取),根据钨化合物在不同溶剂中的浸取率可知,这样可以将WO3溶解同时又能保证不被氧化W2O5,以便在步骤Ⅳ中将W2O5分离出来,
故答案为:将WO3溶解同时又能保证不被氧化W2O5;
(5)根据上面的分析可知,选用的试剂b是 50g/L Na2CO3溶液,固体E中含有的物质是 W、WO2,D中溶质是Na2WO4,
故答案为:50g/L Na2CO3溶液; W、WO2.
点评 本题考查物质的分离与提纯、物质的制备等,题目较为综合且具有一定难度,做题时注意抓住题中信息,选择合适的试剂,侧重对学生获取信息应用信息的能力的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
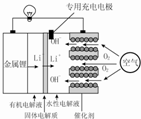
| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
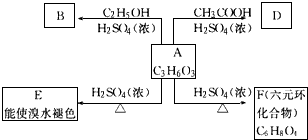
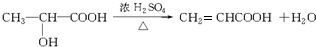 ;A→F
;A→F
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 | |
| B. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| C. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| D. | 新制氯水应保存在无色试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com