
| 17.75g |
| 71g/mol |
| 17.75g |
| 71g/mol |
| 0.25mol×1 |
| 1 |
| 0.25mol×87g/mol |
| 27.86g |
| 0.25mol×2 |
| 1 |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
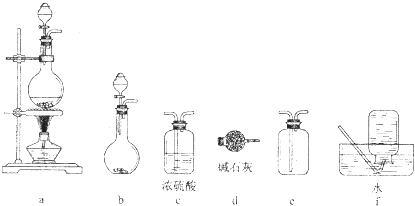
| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气含有NA个原子 |
| B、标准状况下,22.4LH2O含有NA个H2O分子 |
| C、1mol/L的硝酸钠溶液中含有的硝酸根离子数为NA |
| D、甲烷的摩尔质量与NA个甲烷分子的质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com