
| A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O=4H++SO42-+2I- |
| C、2Fe2++Cl2=2Fe3++2Cl- |
| D、2Br-+4H++SO42-=SO2+Br2+2H2O |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
| A、平衡时,乙中CO2的转化率大于50% | ||
| B、当反应平衡时,丙中c(CO2)是甲中的2倍 | ||
C、温度升至800℃,上述反应平衡常数为
| ||
| D、其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
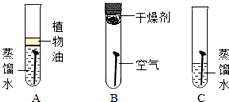 结合下列有关铁的实验,回答有关问题.
结合下列有关铁的实验,回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是吸热反应 |
| B、是放热反应 |
| C、是熵减少的反应 |
| D、熵增大效应大于焓变效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
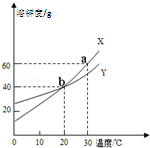
| A、将20℃的饱和溶液X降温到10℃,溶液X仍然是饱和溶液 |
| B、a点表示30℃时,X的溶解度为60g |
| C、b点表示20℃时,X、Y的溶解度相等 |
| D、同质量的X、Y饱和溶液分别从30℃降到10℃时,析出的Y的质量大于X的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、31g仅含有少量白磷,无其他杂质的红磷样品中,共含有NA个磷原子 |
| B、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数小于NA |
| C、1molNa2O2与水反应转移的电子数为NA |
| D、58.5g的氯化钠固体中含有NA个氯化钠分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com