
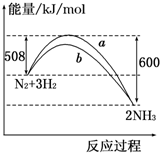
| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
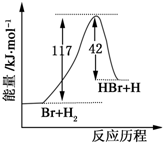
| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、逆反应为吸热反应 |
| D、从图中可看出,该反应的反应热与反应途径有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
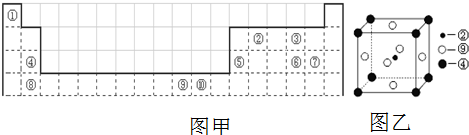
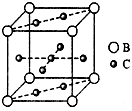 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kj/mol)分别为:578、1 817、2 745、ll 575;E与F能形成原子数目 比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1KNO3溶液:H+、Fe 2+、SCN -、SO42- | ||
| B、pH=0的溶液:Al3+、Cu(NH3)42+、F -、SO42- | ||
| C、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、1:2 |
| C、1:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com