
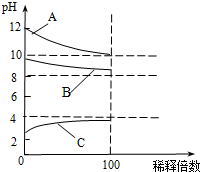
 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH分析 (1)弱酸、弱碱、水都属于弱电解质;
(2)根据CH3COONa 溶液中的水解和电离方程分析;
(3)盐溶液中溶质浓度相同,酸越弱,其盐的酸根水解程度越大,碱性越强,强酸强碱完全电离,弱酸弱碱部分电离;
(4)将 CH3COONa溶液稀释100倍时,pH变化小于2个单位;
(5)Na2CO3与AlCl3溶液发生双水解反应生成二氧化碳气体;
(6)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液的溶质为醋酸和醋酸钠,溶液显酸性.
解答 解:(1)弱酸、弱碱、水都属于弱电解质,则①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH中属于弱电解质的是①CH3COOH;
故答案为:①;
(2)CH3COONa 溶液中的水解方程为CH3COO-+H2O?CH3COOH+OH-,电离方程为H2O?H++OH-,则溶液中离子与分子有CH3COOH、H2O、Na+、CH3COO-、H+、OH-,共6种;
故答案为:6;
(3)氢氧化钠是强碱,不水解,相同浓度的溶液氢氧化钠的pH最大,已知酸性:CH3COOH>H2CO3,所以碳酸钠的水解程度大于醋酸钠,碱性顺序:碳酸钠>醋酸钠,醋酸和硝酸均为酸,pH小于7,硝酸为强酸,完全电离,醋酸部分电离,综上知道五种溶液的pH由小到大的顺序是③<①<④<②<⑤,
故答案为:③<①<④<②<⑤;
(4)CH3COONa溶液显碱性,将 CH3COONa溶液稀释100倍时,pH变化小于2个单位,所以B符合;故答案为:B;
(5)Na2CO3与AlCl3溶液发生双水解反应生成二氧化碳气体,其反应离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
故答案为:②;2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
(6)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液的溶质为醋酸和醋酸钠,溶液显酸性,醋酸钠和醋酸均电离出醋酸根离子,所以c(CH3COO-)>c(Na+),则溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查盐类的水解、弱电解质的电离、电离平衡常数的应用等,注意盐溶液的碱性强弱取决于阴离子的水解能力,当pH相同时,越难水解的盐,其浓度越大,难度中等.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}×{10^{-18}}mol/L$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO?) | |
| B. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH=7 | |
| C. | CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动 | |
| D. | 室温下向pH=3的醋酸溶液中加水稀释,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 稀释后溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水搅拌. (4)转移、洗涤:将烧杯中的溶液注入容量瓶中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用 胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (7)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
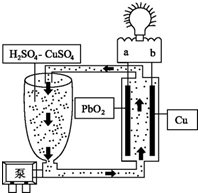 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为正极,b为负极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | b极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com