
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O HSO3-十OH— B.HSO3-十H2O
HSO3-十OH— B.HSO3-十H2O H2SO3十OH-
H2SO3十OH-
C.HSO3-十OH— SO32—十H2O D.H2SO3+OH-
SO32—十H2O D.H2SO3+OH- HSO3-十H2O
HSO3-十H2O
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
碱式氯化铝[ Al2(OH)nCl6-n ] 是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果。其制备流程如下:
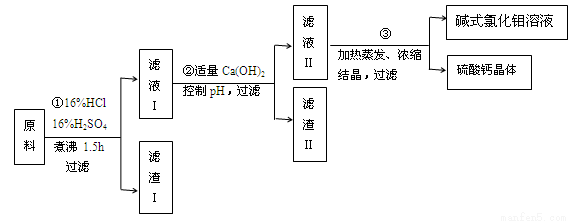
(1)原料需要粉碎,其目的是 ;滤渣I的主要成分是 ;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,此时溶液中呈浅绿色的阳离子常采用加入 试剂进行检验(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为 ;
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是 ;已知碱式氯化铝的分散质粒子大小在1~100 nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,该反应的离子方程式为 ;
(4)某温度下若0.1 mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3溶液时,吸收热量Q kJ ,该过程的热化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4+ + SO42— + Ba2+ +OH—  BaSO4↓+ NH3·H2O
BaSO4↓+ NH3·H2O
B.2Al3+ + 3SO42— +3Ba2+ +6OH— 3BaSO4↓+ 2Al(OH)3↓
3BaSO4↓+ 2Al(OH)3↓
C.Al3+ + 2SO42— + 2Ba2+ + 4OH— 2BaSO4↓+ AlO2— + 2H2O
2BaSO4↓+ AlO2— + 2H2O
D.NH4++Al3+ +2SO42— +2Ba2+ +4OH— 2BaSO4↓+ Al(OH)3↓+ NH3·H2O
2BaSO4↓+ Al(OH)3↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
根据我国统一实行法定计量单位的规定,下列说法比较规范的是
A.98g硫酸的摩尔数为1 mol
B.氧的摩尔质量为32g/mol
C.某硫酸中H2SO4的质量分数为0.60
D.阿伏加德罗常数约为6.02×1023 个
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:实验题
某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,并制备硫酸铜晶体。完成下列填空。甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
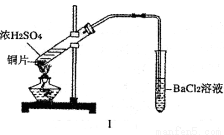
(1)白色沉淀是 。
(2)甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是:
① ②
乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验)。
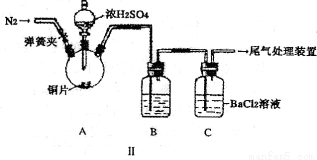
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
(3)操作①的目的是 ,集气瓶B中的试剂是 。
(4)该实验能否检验甲同学上述两种假设中的任意一种 ,理由是 。
丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4·xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如下:
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
第一次称量 | 第二次称量 | ||
11.710g | 22.700g | 18.621g | a |
(5)若无需再进行第三次称量,则a的数值范围应为 。
(6)若加热后坩埚与固体总质量为18.620g,计算x 的实测值 (保留二位小数),相对误差 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2,Na2CO3
C.NaOH,Na2CO3 D.Na2O2,NaOH,Na2CO3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是
A.滴有酚酞的Na2CO3溶液 B.溶有SO2的品红溶液
C.滴有石蕊的CH3COOH溶液 D.滴有酚酞的饱和氢氧化钙溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
0.5体积某气态烃只能与0.5体积氯气发生加成反应,生成氯代烷。0.5mol此氯代烷可与4 mol氯气发生完全的取代反应,则该烃的结构筒式为
A.CH2==CH2 B.CH3CH==CH2
C.CH3CH3 D.CH3CH2CH==CH2
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三总复习质量检测一理综化学试卷(解析版) 题型:简答题
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
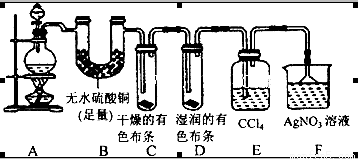
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com