
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸的滴定曲线如图所示。横轴为加入氢氧化钠的体积数,纵轴为溶液的pH。下列正确的是
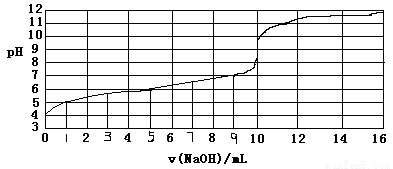
A.此一元弱酸的电离常数(Ka)约为1.0×10-6
B.此弱酸的浓度为1×10-4mol/L
C.此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂
D.此滴定反应为吸热反应
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2014-2015学年浙江省高三第一次五校联考化学试卷(解析版) 题型:填空题
(6分)为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:___________________。
(2)某地污水中的有机污染物主要成分是三氯乙烯(C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:

(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为_____________:实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_____________________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是________________________________。

(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是___________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的分类依据正确的是
物质类别 | 分类依据 | |
A | 酸 | 电离时能否产生氢离子 |
B | 碱性氧化物 | 是否属于金属氧化物 |
C | 胶体 | 能否发生丁达尔现象 |
D | 强电解质 | 水溶液中能否完全电离 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:实验题
(14分)碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组的同学们为了确定某碱式碳酸镁的组成,设下图所示的实验装置。

(1)实验步骤:
①按上图(夹持仪器未画出)组装好置后,首先进行的操作是________。E处干燥管盛放的药品是________________。
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管中;
称量:装浓硫酸的洗气瓶C的质量为m2g;装碱石灰的U形管D的质量为m3g
③打开活塞___________,关闭__________缓缓鼓入空气数分钟。
④关闭活塞_______,打开__________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4g;U形管D的质量为m5g。实验测得数据如下:m1 = 31g ,m2 =87.6g ,m3 = 74.7g,m4 = 89.4g ,m5 = 87.9g,计算推导:该碱式碳酸镁的化学式为_________________。
(2)关于该实验方案,以下说法你认为正确的是______________(填字母)
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)]的化学组成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:填空题
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。

②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。
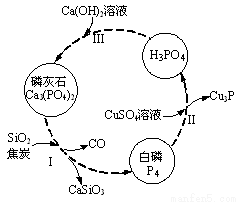
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是

A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将pH=11的氨水稀释1000倍,测得pH > 8,说明NH3·H2O为弱碱
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
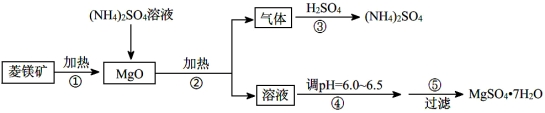
请回答下列问题:
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)步骤⑤的操作为 。
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12]。
(7)药品A是中和胃酸的常用药物,其有效成分是铝和镁的碱式碳酸盐。现进行如下实验确定其化学式:
实验一:取该碱式碳酸盐3.01g充分灼烧至恒重,测得固体质量减少了1.30g;
实验二:另取该碱式碳酸盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
实验三:向实验二的溶液中加入足量的NaOH溶液得到1.74g白色沉淀。
该药品的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
NA为阿佛加德罗常数,下列叙述不正确的是
A.标准状况下,22.4 L的CCl4中所含质子数为74 NA
B.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA
C.12 g石墨晶体中含有的碳碳键数目为1.5 NA
D.分子数为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com