

·ÖĪö £Ø1£©øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćt0”«t1½×¶ĪŅŌCĪļÖŹµÄÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹ£»
£Ø2£©t4”«t5½×¶ĪÕżÄę·“Ó¦ĖŁĀŹ¼õŠ”ĒŅĻąµČ£¬ČēŹĒ½µµĶĪĀ¶Č£¬Ę½ŗāŅĘ¶Æ·¢ÉśŅĘ¶Æ£¬ŌņÕżÄę·“Ó¦ĖŁĀŹ²»ĻąµČ£¬ĖłŅŌŹĒ¼õŠ”ĮĖŃ¹Ē棻øł¾ŻA”¢CÅØ¶ČµÄ±ä»ÆÅŠ¶Ļ¶žÕß¼ĘĮæŹż¹ŲĻµ£¬øł¾Żt4”«t5½×¶ĪÅŠ¶Ļ»Æѧ·½³ĢŹ½£¬Č»ŗóøł¾Ż»Æѧ·½³ĢŹ½¼ĘĖć£»
£Ø3£©øł¾Żt5”«t6½×¶ĪÕżÄę·“Ó¦ĖŁĀŹ±ä»ÆæÉÖŖ£¬t5Ź±ÉżøßĮĖĪĀ¶Č£¬Õż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£¬ĖłŅŌøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£»
£Ø4£©øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ĪĀ¶Č×īøßĘ½ŗā³£ŹżŌö“󣬽įŗĻĪĀ¶Č¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©Čōt1=15min£¬Éś³ÉĪļCŌŚt0”«t1Ź±¼ä¶ĪµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗv=$\frac{”÷c}{”÷t}$=$\frac{0.6mol/L-0.3mol/L}{15s}$=0.02mol•L-1•min-1£¬
¹Ź“š°øĪŖ£ŗ0.02mol•L-1•min-1£»
£Ø2£©t4”«t5½×¶ĪøıäĢõ¼žŗó£¬ÕżÄę·“Ó¦ĖŁĀŹ¶¼¼õŠ”ĒŅĻąµČ£¬ĖłŅŌ²»æÉÄÜŹĒ½µµĶĪĀ¶Č£¬Ó¦øĆĪŖ¼õŠ”Ń¹Ē棻·“Ó¦ÖŠAµÄÅØ¶Č±ä»ÆĪŖ£ŗ1mol/L-0.8mol/L=0.2mol/L£¬CµÄÅØ¶Č±ä»ÆĪŖ£ŗ0.6mol/L-0.3mol/L=0.3mol/L£¬·“Ó¦ÖŠAÓėCµÄ»Æѧ¼ĘĮæŹżÖ®±ČĪŖ0.2£ŗ0.3=2£ŗ3£¬øł¾Żt4”«t5½×¶ĪøıäŃ¹ĒæĘ½ŗā²»ŅʶÆæÉÖŖ£¬øĆ·“Ó¦µÄ·½³ĢŹ½ĪŖ2A£Øg£©+B£Øg£©?3C£Øg£©£»ÓÉ·½³ĢŹ½æÉÖŖ·“Ó¦¹ż³ĢÖŠĻūŗĵÄBµÄĪļÖŹµÄĮæÅضČĪŖ£ŗ£Ø1mol/L-0.8mol/L£©”Į$\frac{1}{2}$=0.1mol/L£¬ĖłŅŌBµÄĘšŹ¼ÅضČĪŖ0.4mol/L+0.1mol/L=0.5mol/L£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė4mol A”¢1.2mol CŗĶŅ»¶ØĮæµÄBČżÖÖĘųĢ壬AµÄĘšŹ¼ÅضČĪŖ1.0mol/L£¬Ģå»ż=$\frac{4mol}{1.0mol/L}$=4L£¬ĪļÖŹµÄĮæ=0.5mol/L”Į
4L=2mol£¬
¹Ź“š°øĪŖ£ŗ¼õŠ”Ń¹Ē棻 2mol£»
£Ø3£©øĆ·“Ó¦ŹĒĢå»ż²»±äµÄ·“Ó¦£¬¶ųt5”«t6½×¶ĪÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬ĖµĆ÷ŹĒÉżøßĮĖĪĀ¶Č£»ÉżøßĪĀ¶ČŗóÕż·“Ó¦ĖŁĀŹ“óÓŚÄę·“Ó¦ĖŁĀŹ£¬ĖµĆ÷øĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬Äę·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬
¹Ź“š°øĪŖ£ŗÉżøßĪĀ¶Č£»·ÅČČ·“Ó¦£»
£Ø4£©øł¾Ż£Ø3£©æÉÖŖøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£¬ĪĀ¶ČŌ½øßĘ½ŗā³£ŹżŌ½“ó£¬øł¾ŻĶ¼ĻóĒśĻß±ä»ÆæÉÖŖ£¬VŹ±·“Ó¦ĖŁĀŹ×ī“ó£¬ĖµĆ÷“ĖŹ±ĪĀ¶Č×īøߣ¬ŌņĘ½ŗā³£Źż×ī“óµÄŹĒV£¬
¹Ź“š°øĪŖ£ŗ¢õ£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Éę¼°»Æѧ·“Ó¦Ę½ŗāÓ°ĻģŅņĖŲµÄ·ÖĪöÅŠ¶Ļ”¢ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“µČÖŖŹ¶£¬½āĢā¹Ų¼üŹĒĆ÷Č·Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹ”¢»ÆŃ§Ę½ŗāµÄŅņĖŲ£¬£Ø3£©ĪŖŅדķµć£¬×¢Ņāøł¾ŻĶ¼ĻóÅŠ¶ĻøĆ·“Ó¦ĪŖĪüČČ·“Ó¦£®


 ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 200mL 2 mol/LMgCl2ČÜŅŗ | B£® | 1000mL 2.5 mol/L NaClČÜŅŗ | ||
| C£® | 300mL 5 mol/L KClČÜŅŗ | D£® | 250mL 1 mol/L FeCl3ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
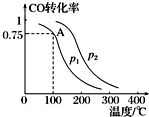 ĄūÓĆCOŗĶH2æÉŅŌŗĻ³É¼×“¼£¬·“Ó¦ŌĄķĪŖCO£Øg£©+2H2£Øg£©ØTCH3OH£Øg£©£®Ņ»¶ØĢõ¼žĻĀ£¬ŌŚČŻ»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ³äČėa mol COÓė2a mol H2ŗĻ³É¼×“¼£¬Ę½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®
ĄūÓĆCOŗĶH2æÉŅŌŗĻ³É¼×“¼£¬·“Ó¦ŌĄķĪŖCO£Øg£©+2H2£Øg£©ØTCH3OH£Øg£©£®Ņ»¶ØĢõ¼žĻĀ£¬ŌŚČŻ»żĪŖV LµÄĆܱÕČŻĘ÷ÖŠ³äČėa mol COÓė2a mol H2ŗĻ³É¼×“¼£¬Ę½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
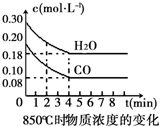 ŌŚŅ»Ģå»żĪŖ10LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄCOŗĶH2O£Øg£©£¬ŌŚ850”ꏱ·¢ÉśČēĻĀ·“Ó¦£ŗCO£Øg£©+H2O£Øg£©?CO2£Øg£©+H2£Øg£©£®COŗĶH2O£Øg£©ÅØ¶Č±ä»ÆČēĶ¼
ŌŚŅ»Ģå»żĪŖ10LµÄČŻĘ÷ÖŠ£¬ĶØČėŅ»¶ØĮæµÄCOŗĶH2O£Øg£©£¬ŌŚ850”ꏱ·¢ÉśČēĻĀ·“Ó¦£ŗCO£Øg£©+H2O£Øg£©?CO2£Øg£©+H2£Øg£©£®COŗĶH2O£Øg£©ÅØ¶Č±ä»ÆČēĶ¼| Ź±¼ä£Ømin£© | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0J062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com