
【题目】下列说法中正确的是( )
A.碳酸氢钠的热稳定性比碳酸钠的强
B.等质量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者产生的二氧化碳多
C.足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生的二氧化碳一样多
D.等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多
【答案】D
【解析】
试题分析:A.NaHCO3不稳定,加热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠受热稳定,故A错误;B.等质量的碳酸钠、碳酸氢钠,n(NaHCO3)>n(Na2CO3),分别与足量的盐酸反应,NaHCO3生成的二氧化碳多,故B错误;C.与盐酸反应时分别发生:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,则足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,产生的气体不一样多,故C错误;D.根据反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑可知,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多,故D正确,故选D。
Na2CO3+CO2↑+H2O,碳酸钠受热稳定,故A错误;B.等质量的碳酸钠、碳酸氢钠,n(NaHCO3)>n(Na2CO3),分别与足量的盐酸反应,NaHCO3生成的二氧化碳多,故B错误;C.与盐酸反应时分别发生:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,则足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,产生的气体不一样多,故C错误;D.根据反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑可知,等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多,故D正确,故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】某芳香族化合物与苯酚无论以何种比例混合,只要总物质的量一定,完全燃烧时所消耗的氧气和生成水的质量始终一定.试回答: 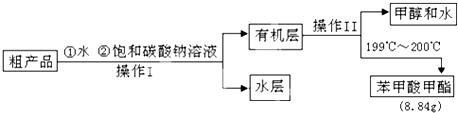
(1)这类物质的相对分子质量与苯酚的相对分子质量之差为的倍数(填数字).
(2)这类物质中相对分子质量最小的物质A的分子式为C7H6O3 . 已知A溶液能与NaHCO3反应放出气体,且能与溴水反应.
①A可能的结构有种.
②现取2.32g苯酚与A的混合物与50.0mL 1.000mol/L的NaOH溶液充分反应后,加水至100mL.取出其中的10.0mL用0.100mol/L的HCl溶液滴定过量的NaOH,消耗20.0mL时至滴定终点.求该混合物中苯酚的质量分数(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质,但类比是相对的,不能违背客观实际。下列说法中,不正确的是
A. CO2通入水中生成H2CO3,SO2通入水中生成H2SO3
B. CO2通入CaCl2溶液中无明显现象,SO2通入CaCl2溶液中也无明显现象
C. 足量的CO2通入到澄清石灰水中,先生成沉淀后溶解,足量的SO2通入到澄清石灰水中现象相同
D. CO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]() ,SO2通入
,SO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有如下仪器:①试管 ②烧杯 ③量筒 ④蒸发皿 ⑤锥形瓶 ⑥温度计 ⑦蒸馏烧瓶 ⑧分液漏斗
试回答下列问题:
(1)可以直接加热的有___(填序号,下同);
(2)加热时必须垫上石棉网的有___;
(3)使用前必须查漏的有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置(尾气处理已略去)进行相关实验,能实现实验目的的是

实验目的 | a中试剂 | b中试剂 | c中试剂 | |
A | 比较 | 醋酸溶液 | 碳酸钠 | 硅酸钠溶液 |
B | 比较 | 浓盐酸 | 高锰酸钾 | 碘化钾溶液 |
C | 证明苯和液溴发生取代反应 | 苯和液溴 | 铁粉 | 硝酸银溶液 |
D | 证明 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
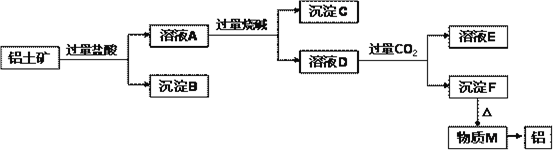
请回答下列问题:
⑴图中涉及分离溶液与沉淀的实验方法是__________(填操作名称)。
⑵沉淀B的成分是___________(填化学式,下同);沉淀C的成分是___________;溶液D中大量存在的阴离子是___________。
⑶沉淀F转化为物质M的化学方程式为___________;由物质M制取铝的化学方程式为___________;溶液D中通入过量CO2生成沉淀F的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]() 。将一定量的
。将一定量的![]() 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
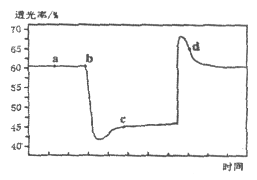
A. b点的操作是压缩注射器
B. c点与a点相比, ![]() 增大,
增大, ![]() 减小
减小
C. 平均摩尔质量: ![]()
D. d点: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com