
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
分析 (1)根据标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点颜色的变化;
(2)滴定时根据锥形瓶中溶液颜色变化来判断滴定终点;
(3)根据锥形瓶装液前不能润洗;根据根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$判断不当操作对相关物理量的影响;
(4)酸式滴定管要用标准盐酸溶液润洗;
(5)根据滴定管的结构和精确度;
(6)先判断数据的合理性,然后盐酸溶液的平均体积,然后根据HCl~NaOH求NaOH溶液的物质的量浓度.
解答 解:(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,
故答案为:红;无;
(2)滴定时根据锥形瓶中溶液颜色变化来判断滴定终点,所以滴定时眼睛要注视锥形瓶内容液颜色变化;
故答案为:锥形瓶内容液颜色变化;
(3)锥形瓶装液前不能润洗;若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(酸)增大,根据c(碱)=$\frac{c(酸)×V(酸)}{V(碱)}$可知,c(碱)偏高;
故答案为:锥形瓶不能用待测液润洗;偏高;
(4)酸式滴定管用蒸馏水洗净后,要用标准盐酸溶液润洗,否则,盐酸的浓度会减小,从而产生误差;
故答案为:用标准液润洗滴定管;
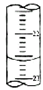
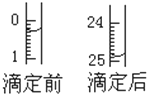
(5)滴定管中的液面的读数为22.60mL,故答案为:22.60;
(6)两次消耗的盐酸标准液的体积为19.90mL,20.10mL,均有效,盐酸溶液的平均体积为$\frac{19.90mL+20.10mL}{2}$=20.00mL,
HCl~~~~~NaOH
1 1
0.1000mol•L-1×20.00 c(烧碱)×25.00
解得c(盐酸)=0.08mol/L,
故答案为:0.08.
点评 本题考查酸碱中和滴定,题目难度中等,明确中和滴定实验的仪器、步骤、终点的判定、数据处理等即可解答,注意把握误差分析的方法,侧重于考查学生的分析能力和计算能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
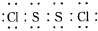 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
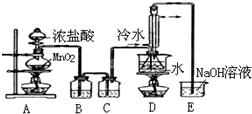
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
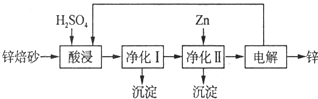
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰 | B. | 亚硫酸钠(Na2SO3) | C. | 铁粉 | D. | 硫酸亚铁(FeSO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com