
【题目】乙烯与甲苯都是重要的有机化工原料.
(1)乙烯通入到Br2水中,现象是_____________.
(2)由甲苯获取食品香料添加剂苯甲酸苯甲酯,存在下列转化:
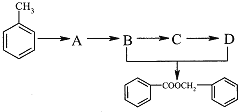
回答下列问题:
①C中的官能团名称____________,C→D的反应类型________________.
②B→C的化学方程式为________________.
③B+D→ ![]() 的化学方程式为_____________________.
的化学方程式为_____________________.
④A的化学式为C7H7Cl,则含有苯环的A的同分异构体还有______________种.
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
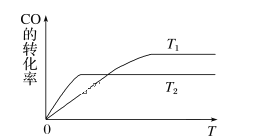
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
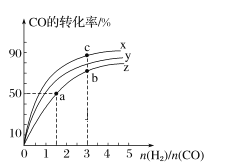
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.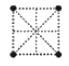 B.
B.  C.
C.  D .
D .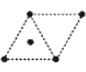
a. 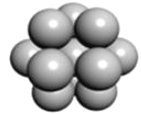 b.
b. 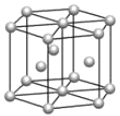 c.
c. 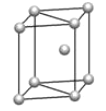
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:

(1)指出提取碘的过程中有关的实验操作名称:①____________________;③______________。
若实验②中采用酸性条件下加入双氧水,则有关反应的离子方程式_________________________________。
(2)提取碘的过程中,可供选择的有关试剂是___________。
A.甲苯,酒精B.四氯化碳,苯C.汽油,乙酸D.汽油,甘油
(3)含碘的有机溶液后期处理得到晶态碘需要进行的操作为___________;
最后,晶态碘在___________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是____________________。
②整套实验装置存在一处明显的不足,请指出__________________。
(2)用改正后的装置进行实验,实验过程如下:_______。
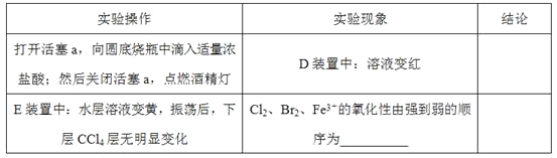
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。

(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=![]() ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com