
【题目】Ⅰ. (1)右图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图。已知E1=134 kJ·mol-1,E2=368 kJ·mol-1(E1、 E2为反应的活化能)。若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是____、____(填“增大”、“减小”或“不变”)。写出该反应的热化学方程式:__。

(2)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行,则ΔH ___(填字母)0。
A.大于 B.小于 C.等于 D.大于或小于都可
Ⅱ. 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH = Q kJ·mol-1 (Q>0)。在密闭容器中,按CO2与H2的物质的量之比为1∶3进行投料,在5 MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示。
CH3CH2OH(g)+3H2O(g) ΔH = Q kJ·mol-1 (Q>0)。在密闭容器中,按CO2与H2的物质的量之比为1∶3进行投料,在5 MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示。

完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是____(填字母)。
(2)其他条件恒定,达到平衡后,能提高H2转化率的措施是____(填字母)。
A.升高温度 B.充入更多的H2
C.移去乙醇 D.增大容器体积
(3)图中曲线a和c的交点R对应物质的体积分数为____。
【答案】 减小 不变 NO2(g)+CO(g) ═ NO(g)+CO2(g)ΔH = -234 kJ·mol-1 B b AC 37.5% (或0.375)
【解析】本题主要考查化学平衡的移动,
Ⅰ. (1)若在反应体系中加入催化剂,活化能减小,反应热不变,则E1、ΔH的变化分别是减小、不变。该反应的热化学方程式:NO2(g)+CO(g) ═ NO(g)+CO2(g)ΔH=E1、E2=-234kJ·mol-1。
(2)该反应气体物质的量减小,△S<0,在150℃下能自发进行,即△H –T△S<0,则ΔH<0,故选B。
Ⅱ.(1)升温平衡右移,随着温度升高,生成物的体积分数在增大,而且CH3CH2OH(g)比H2O(g)增大得慢,所以表示CH3CH2OH体积分数曲线的是b。
(2)A.升高温度,平衡右移,H2转化率提高;B.充入更多的H2,H2转化率降低;C.移去乙醇,生成物浓度减小,平衡右移,H2转化率提高;D.增大容器体积即减压,平衡左移,H2转化率降低。故选AC。
(3)设CO2与H2的物质的量分别为1mol与3mol,H2的转化率为x,图中曲线a和c的交点R对应物质分别是H2和H2O,根据题意得3-3x=1.5x,x=2/3,H2和H2O的体积分数为(3-3x)/(4-2x)=3/8=37.5% (或0.375).


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A. Na+ AlO2- Cl- SO42-
B. K+ MnO4- Cl- SO42-
C. SO42- Na+ HCO3- Ba2+
D. Na+ NO3- NH4+ SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.15g金属钠跟水反应后,得到100mL溶液,试计算:(已知方程式2Na+2H2O=2NaOH+H2↑)
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液中溶质的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为____________________。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NH3在标准状况下是____L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH = -196.6 kJ·mol-1
2SO3(g) ΔH = -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH = -113.0 kJ·mol-1
2NO2(g) ΔH = -113.0 kJ·mol-1
①则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
SO3(g)+NO(g)的ΔH = ____ kJ·mol-1。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=____。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。
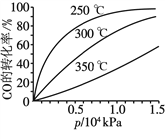
该反应的ΔH ____(填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________。
(4)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g) ═ N2(g)+CO2(g)+2H2O(g) ΔH = -867 kJ·mol-1
2NO2(g)![]() N2O4(g) ΔH = -56.9 kJ·mol-1
N2O4(g) ΔH = -56.9 kJ·mol-1
H2O(g)![]() H2O(l) ΔH = -44 kJ·mol-1
H2O(l) ΔH = -44 kJ·mol-1
写出CH4 催化还原N2O4(g) 生成N2(g)、CO2(g) 和H2O(l)的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H—H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N—H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol,可知![]() 键的键能是______________kJ/mol
键的键能是______________kJ/mol
(2)碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
O2(g)===CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________
(3)运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,图中的括号内应填入___(“+”或“-”)。

②写出表示丙烷燃烧热的热化学方程式:________________。
(4)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
由以上表格中数据判断以下说法不正确的是__________。
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为: H2SO4 = 2H++S![]()
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
(5)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是________。
A.c(H+) B.![]() C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: 
(1)该浓盐酸的物质的量浓度为molL﹣1 .
(2)下列容量瓶的使用方法中,不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.200molL﹣1的稀盐酸. ①该学生需要用量筒量取mL上述浓盐酸进行配制.
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容.
B.用量筒量取浓盐酸时俯视观察凹液面.
C.在容量瓶中定容时俯视刻度线.
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com