
分析 根据反应2Fe3++Fe=3Fe2+可知,0.2molFe3+完全反应消耗Fe的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol<0.2mol,说明Fe过量,根据铁离子的物质的量计算出反应后生成Fe2+的物质的量,再根据c=$\frac{n}{V}$计算出所得溶液中Fe2+的物质的量浓度.
解答 解 向含有0.2mol Fe3+的500mL 溶液中加入 0.2mol Fe粉,发生反应为:2Fe3++Fe=3Fe2+,
0.2molFe3+完全反应消耗Fe的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol<0.2mol,说明Fe过量,反应后生成Fe2+的物质的量为:n(Fe2+)=0.2mol×$\frac{3}{2}$=0.3 mol,
所以所得溶液中Fe2+的物质的量浓度为:c(Fe2+)=$\frac{0.3mol}{0.5L}$=0.6mol/L,
答:所得溶液中Fe2+的物质的量浓度为0.6mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷、苯都不能发生氧化反应 | |
| B. | 乙烯、聚乙烯都可与溴水发生加成反应 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇类物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 000mL | B. | 500mL | C. | 100mL | D. | 1 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、SO42-、HCO3- | B. | Fe2+、Na+、SO42-、NO3- | ||
| C. | Na+、K+、AlO2-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-)+c(OH-) | B. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | D. | c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+ K+ OH- NO3- | B. | Na+ Ca2+ HCO3- NO3- | ||
| C. | Ag+ K+ Cl- NO3- | D. | Na+ Cu2+ SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定存在共价键和范德华力 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
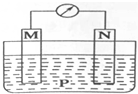 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )| 选项号 | M | N | P |
| A | 铜 | 铁 | 稀盐酸 |
| B | 银 | 锌 | 硝酸银溶液 |
| C | 锌 | 铁 | 硝酸铁溶液 |
| D | 锌 | 铜 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com