
| ������� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| �� | 1 | 4 | 0 | 0 | t1 | �ų�������32.8kJ | |
| �� | 2 | 8 | 0 | 0 | t2 | �ų�������Q | |
���� ��1������ӦΪ���ȷ�Ӧ����ϼ����յ�������С�ڳɼ��ų�����������
��2��ƽ��ʱ�ų�����Ϊ32.8 kJ����μӷ�Ӧ��COΪ$\frac{32.8kJ}{41kJ/mol}$=0.8mol����������COת���ʣ�
��3�������١����¶���ͬ��ƽ�ⳣ����ͬ������������������CO���ʵ���������ƽ��ʱ�����ʵ����ʵ�������Ӧǰ������������䣬�����ʵ�������Ũ�ȴ���K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$����ƽ�ⳣ����
��4��a�������١�����CO��H2O��ʼ���ʵ���֮�Ⱦ�Ϊ1��4����Ӧǰ������������䣬���º����¶���Ϊ��Чƽ�⣬ƽ��ʱͬ�����ʵĺ�����ȣ�
b�������١���Ϊ��Чƽ�⣬ƽ��ʱCOת������ȣ������������з�ӦCO�����ʵ���������Ȼ�ѧ����ʽ����ų���������
c��Ũ��Խ��Ӧ����Խ�죻
d���ɷ���ʽ��֪���ɵ�ˮ�����ʵ�����������CO���ʵ���������v=$\frac{��c}{��t}$����v��H2O����
��5����֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2��g��+O2��g���T2H2O ��g����H=-484kJ/mol��
���ݸ�˹���ɣ��١�2+�ڿɵã�2CO��g��+O2��g����2CO2��g����
��� �⣺��1������ӦΪ���ȷ�Ӧ����Ӧ����ӻ�ѧ������ʱ�����յ�������С����������ӻ�ѧ���γ�ʱ���ͷŵ����������ʴ�Ϊ��С�ڣ�
��2��ƽ��ʱ�ų�����Ϊ32.8 kJ����μӷ�Ӧ��COΪ$\frac{32.8kJ}{41kJ/mol}$=0.8mol����COת����Ϊ$\frac{0.8mol}{1mol}$��100%=80%���ʴ�Ϊ��80��
��3�������١����¶���ͬ��ƽ�ⳣ����ͬ��������������CO���ʵ���Ϊ0.8mol����
CO��g��+H2O��g���TCO2��g��+H2��g��
��ʼ����mol����1 4 0 0
�仯����mol����0.8 0.8 0.8 0.8
ƽ������mol����0.2 3.2 0.8 0.8
��Ӧǰ������������䣬�����ʵ�������Ũ�ȼ���ƽ�ⳣ������K=$\frac{c��C{O}_{2}����c��{H}_{2}��}{c��CO����c��{H}_{2}O��}$=$\frac{0.8��0.8}{0.2��3.2}$=1��
�ʴ�Ϊ��1��
��4��a�������١�����CO��H2O��ʼ���ʵ���֮�Ⱦ�Ϊ1��4����Ӧǰ������������䣬���º����¶���Ϊ��Чƽ�⣬��������H2�����������ȣ���a��ȷ��
b�������١���Ϊ��Чƽ�⣬ƽ��ʱCOת������ȣ��������з�ӦCO�����ʵ���Ϊ2mol��80%=1.6mol���ų�������Ϊ1.6mol��41kJ/mol=65.6kJ����b����
c���������з�Ӧ����ʼŨ�ȱȢ��еĴ��������п�ʼ��Ӧ���ʽϿ죬��c����
d���ɷ���ʽ��֪���ɵ�ˮ�����ʵ�����������CO���ʵ�������v��H2O��=$\frac{\frac{0.8mol}{VL}}{{t}_{1}min}$=$\frac{0.8}{V{t}_{1}}$mol/��L��min������d����
��ѡ��a��
��5����֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2��g��+O2��g���T2H2O ��g����H=-484kJ/mol��
���ݸ�˹���ɣ��١�2+�ڿɵã�2CO��g��+O2��g����2CO2��g����H=-566 kJ/mol��
�ʴ�Ϊ��2CO��g��+O2��g����2CO2��g����H=-566 kJ/mol��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���˹����Ӧ�á�ƽ�ⳣ���ȣ�Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬ע������Чƽ����ɣ�1�����º��ݣ���Ӧǰ������������ȣ�����ѧ������ת��һ�ߣ���Ӧ���������������Ӧǰ�����������ȣ�����ѧ������ת��һ�ߣ���Ӧ��������ȱȣ�2�����º�ѹ������ѧ������ת��һ�ߣ���Ӧ��������ȱȣ�


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ײ���a-Fe��ĩ���г�ǿ���ԣ����������ܶȴż�¼�Ľ��ʺ�Ч�����ȣ�ijУ��ѧС��ѧ��������ͼ��ʾװ�ý���̽��ʵ�飬��֪��Уʵ���ҵľƾ��ƻ�����¶�ԼΪ500�森
�������ײ���a-Fe��ĩ���г�ǿ���ԣ����������ܶȴż�¼�Ľ��ʺ�Ч�����ȣ�ijУ��ѧС��ѧ��������ͼ��ʾװ�ý���̽��ʵ�飬��֪��Уʵ���ҵľƾ��ƻ�����¶�ԼΪ500�森| ʵ�鲽�� | ʵ����� | ʵ������ |
| �� | ȡ������Ӧ��ĺ�ɫ��ĩX�������������ᣬ�� | ��ɫ��ĩ���ܽ⣬��Һ��dz��ɫ�������������� |
| �� | ��ʵ��I�еõ�����Һ�μ�2��KSCN��Һ���� | ��Һû�г��ֺ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ���/mL | ���������/mL | |
| �ζ�ǰ���� | �ζ������ | ||
| ��1�� | 20.00 | 4.10 | 29.10 |
| ��2�� | 20.00 | 0.00 | 24.90 |
| ��3�� | 20.00 | 4.00 | 29.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ� ���� | ������Һ�������mL�� | 0.100 0mol•L-1NaOH�������mL�� | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ�����mL�� | ||
| ��һ�� | 20.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 20.00 | 1.56 | 30.30 | 28.74 |
| ������ | 20.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | �ζ�ǰ������mL�� | �ζ��������mL�� |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
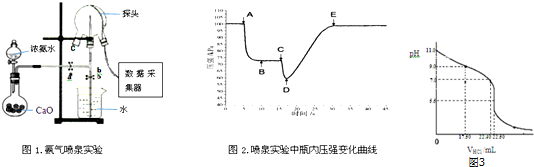
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
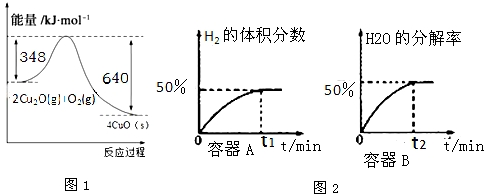
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com