

 ;A→F
;A→F
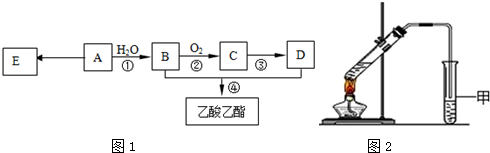
分析 A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,说明羟基不在碳链的端点上,可判断A为CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能发生银镜反应,A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,则E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子A发生酯化反应生成环状化合物,故F为 ,据此分析解答.
,据此分析解答.
解答 解:A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,说明羟基不在碳链的端点上,可判断A为CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能发生银镜反应,A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,则E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子A发生酯化反应生成环状化合物,故F为 ,
,
(1)由上述分析可知,A为CH3CH(OH)COOH,B为CH3CH(OH)COOCH2CH3,D为CH3COOCH(CH3)COOH,
故答案为:CH3CH(OH)COOH;CH3CH(OH)COOCH2CH3;CH3COOCH(CH3)COOH;
(2)A→E是乳酸在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOH,反应方程式为: ,该反应类型是消去反应;
,该反应类型是消去反应;
A→F是乳酸在浓硫酸、加热条件下发生酯化反应生成环状化合物 ,反应方程式为:
,反应方程式为: ,该反应是酯化反应或取代反应,
,该反应是酯化反应或取代反应,
故答案为: ;
; ;消去反应;酯化反应或取代反应.
;消去反应;酯化反应或取代反应.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断A结构简式是解本题关键,熟悉常见有机物官能团及其性质,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
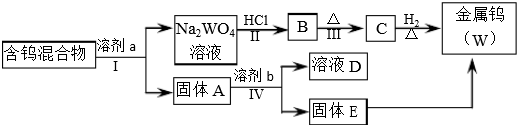
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
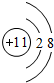 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: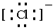 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com