
| A、稀盐酸 | B、稀硝酸 |
| C、氨水 | D、氢氧化钠溶液 |
科目:高中化学 来源: 题型:
| A、标准状况下,将6.72L的NO2通入足量的水中转移电子数为0.3NA |
| B、22.4L二氧化硫分子中电子总数约为32NA |
| C、1mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
| D、各5.6g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④⑤⑦ |
| C、①③⑤⑦ | D、①③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
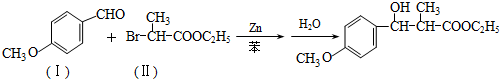
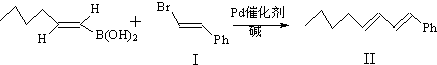
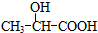 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):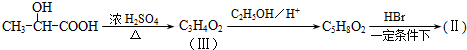
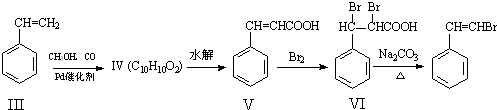
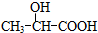 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为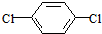 也能与有机物(Ⅰ)(过量)发生类似反应①的系列反应,其生成有机物的结构简式为
也能与有机物(Ⅰ)(过量)发生类似反应①的系列反应,其生成有机物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 结论 |
| ①将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中 | _ | _ |
| ②向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解. | 固体完全溶解 | 证明猜想 |
| ③向另一试管中加入足量的 | 固体完全溶解 | 猜想 |
| 得出结论:综合实验②③的现象,可推知猜想 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 ):
):
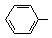
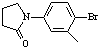 )与化合物(
)与化合物(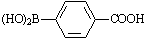 )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mol?L-1 |
| B、4 mol?L-1 |
| C、4.5 mol?L-1 |
| D、5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③④ |
| C、①②④ | D、①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com