
 如图是实验室制取乙酸乙酯的装置.请回答下列问题:
如图是实验室制取乙酸乙酯的装置.请回答下列问题:分析 (1)浓硫酸起到了催化作用和吸水作用;
(2)加热液体时加入碎瓷片时为了防止溶液暴沸飞溅;
(3)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;乙酸乙酯密度小于水.
解答 解:(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,故答案为:催化剂;吸水剂;
(2)烧瓶中加入碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(3)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,故答案为:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,乙酸乙酯的密度小于水,故在上层,故答案为:中和乙酸、溶解乙醇;降低乙酸乙酯的溶解度,有利于分层; 乙酸乙酯.
点评 本题考查了乙酸乙酯的制备,题目难度不大,涉及浓硫酸、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 点燃镁、铝前应用砂纸打磨,除去表面的氧化膜 | |
| B. | 用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来 | |
| C. | 铁在氧气中燃烧的产物主要成分是Fe2O3 | |
| D. | 金属单质在自然界中都以化合物存在,因为它们都有较强的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
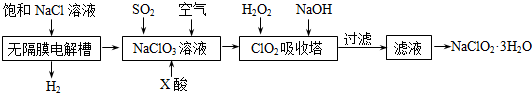
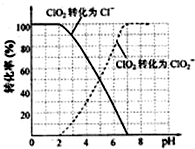
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲表示2molH2(g)所具有的能量一定比2mol气态水所具有的能量多483.6KJ | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的HA溶液的pH小于HB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第15列元素原子的最外层电子排布为ns2 np5 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第9列元素是铁元素 | |
| D. | 第9列中元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com