
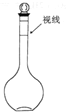
 欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )
欲配制100ml 1.0mol/L Na2SO4溶液,下列说法正确的是( )| A. | ②④ | B. | ②③ | C. | ①③ | D. | 以上都不对 |
分析 ①14.2gNa2SO4的物质的量为$\frac{14.2}{142}$=0.1mol,根据c=$\frac{n}{V}$以及溶液的体积不等于溶剂的体积来分析;
②根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,据此计算稀释后浓度,进行判断;
③定容时俯视容量瓶刻度线,水加少了,导致浓度偏大;
④摇匀后发现液面低于刻度线需再加水至刻度线,水加多了,浓度偏低.
解答 解:①14.2gNa2SO4的物质的量为$\frac{14.2}{142}$=0.1mol,根据c=$\frac{n}{V}$以及溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故②正确;
③定容时俯视容量瓶刻度线,水加少了,导致浓度偏大,③正确;
④摇匀后发现液面低于刻度线需再加水至刻度线,水加多了,浓度偏低,④错误,
故选:B.
点评 本题主要考查配制一定物质的量浓度的溶液的配制及对物质的量浓度的理解、计算,难度不大,注意配制中物质溶于水溶质发生变化的情况以及稀释前后溶质的物质的量不变.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(一题多变题组)关于物质的量各物理量之间的相互转化
(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为___________;同质量的氨气和硫化氢气体的物质的量比为_____________,所含原子个数比为__________;若两者所含氢原子数相等,它们的物质的量比是_____________。
(2)标准状况下,①4 g氢气、② 33.6 L甲烷、③ 6.02×10 23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
(3)现有质量为a g某气体A2B,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____ ___mol,该气体所含原子总数为___ ____个,该气体在标准状况下的体积为____________L。
(学法题)通过解答本题,在解题时应先将各种已知量转化为 再进行计算。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
VL Fe2(S O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
O4)3溶液中含有Fe3+ m g,则溶液中SO42﹣的物质的量浓度为
A.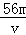 mol/L B.
mol/L B.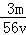 mol/L C.
mol/L C.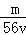 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
| 1 | 27.23 | 25.00 |
| 2 | 28.24 | 25.00 |
| 3 | 27.25 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HB-+A-═HA+B2- | B. | H3C+3A-═3HA+C3- | ||
| C. | H3C+B2-═HB-+H2C- | D. | H3C+3OH-═3H2O+C3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com