
| A. | 共价化合物分子中的化学键可能含有离子键 | |
| B. | 含有金属元素的化合物-定是离子化合物 | |
| C. | 需要加热才能发生的反应是吸热反应 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小 |
分析 A.共价化合物中只含共价键;
B.金属元素与非金属元素也能形成共价键;
C.需要加热才能发生的反应不一定是吸热反应,要根据反应物总能量和生成物总能量相对大小判断;
D.旧键断裂时吸收的能量和新键生成时释放的能量的相对大小决定该反应是吸热反应还是放热反应.
解答 解:A.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故A错误;
B.金属元素与非金属元素也能形成共价键,如Al与氯气反应生成的氯化铝属于共价化合物,含有共价键,故B错误;
C.需要加热才能发生的反应不一定是吸热反应,如铝热反应是放热反应,故错误;
D.旧键断裂时吸收的能量和新键生成时释放的能量的相对大小决定该反应是吸热反应还是放热反应,吸收的总能量大于放出的总能量,则该反应是吸热反应,否则是放热反应,故D正确;
故选D.
点评 本题考查了化合物和化学键的关系、反应的吸热和放热,根据化合物中存在的化学键确定化合物类型,不能根据是否含有金属元素确定化合物类型,为易错点.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| B. | 4.0 g NaOH固体溶于100 mL水中,得到1 mol/L的 NaOH溶液 | |
| C. | 常温、常压下,22 g CO2中含有的氧原子数为NA | |
| D. | 0.5 mol/L Na2SO4溶液中,含有的离子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b=a+1 | |
| B. | 某溶液由水电离的c(OH-)=1.0x10-13mol/L,则此溶液一定显酸性 | |
| C. | 将pH=4的醋酸稀释1000倍,溶液的pH=7 | |
| D. | pH=13的强碱溶液和pH=2的强酸溶液混合,若所得溶液的pH=7,则强碱与强酸的体积比是1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
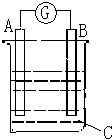 请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,
请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、SO42-、Cl-不能大量共存,只是因为:Mg2++SO42-═MgSO4↓ | |
| B. | H+、Fe2+、NO3-ClO-不能大量共存,只是因为:H++ClO-═HClO | |
| C. | K+、Ca2+、SiO32-、Cl-不能大量共存,只是因为:Ca2++SiO32-═CaSiO3↓ | |
| D. | Fe3+、NH4+、HCO3-、SCN-不能大量共存,这是因为:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
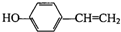 ,其含氧官能团的名称为羟基;
,其含氧官能团的名称为羟基;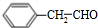 ;
; +NaOH→
+NaOH→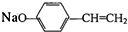 +H2O
+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com