
| A. | ①⑤ | B. | ③④⑤ | C. | ①④⑥ | D. | ①②③ |
分析 ①氮气与氧气都是双原子分子,结合阿伏伽德罗定律解答;
②氩气为单原子分子,氢气为双原子分子,结合阿伏伽德罗定律解答;
③钠与氧气反应无论生成氧化钠还是过氧化钠,钠都变为+1价钠离子;
④气体摩尔体积使用对象为气体;
⑤氧气与臭氧都是由氧原子构成,依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
⑥氯气与铁反应生成氯化铁,氯气少量,依据氯气的量计算转移电子数.
解答 ①依据阿伏伽德罗定律:同温同压下,相同体积的气体具有相同分子数,可知11.2L以任意比例混合的氮气和氧气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氮气与氧气都是双原子分子,所以混合气体含有原子物质的量为1mol,个数为NA,故正确;
②依据阿伏伽德罗定律:同温同压下,体积相同的氢气和氩气具有相同的分子数,但是氩气为单原子分子,氢气为双原子分子,所以二者含有原子数不同,故错误;
③2.3克Na物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,与O2完全反应生成0.1mol钠离子,转移的电子数目等于0.1NA,故错误;
④标况下,水是液体,不能使用气体摩尔体积,故错误;
⑤32g O2和O3混合气体中含有原子数为$\frac{32g}{16g/mol}$×NA=2NA,故正确;
⑥lmol C12与足量Fe完全反应生成氯化铁,氯气少量完全反应生成2mol氯离子,转移2mol电子,个数为2NA,故错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用对象,稀有气体为单原子分子的结构特点是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
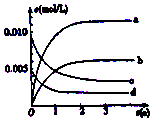 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
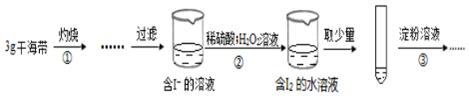
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 正丁烷的二氯代物有6种 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色与乙烯使酸性重铬酸钾变色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2 Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2+H2O↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
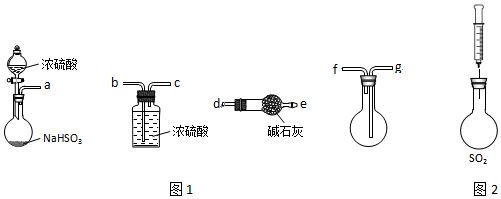
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com