
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
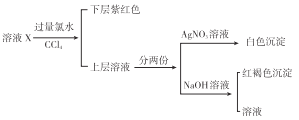
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断不正确的是
A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 实验①中,用160 mL10 mol/L的浓盐酸与足量KMnO4充分反应,标准状况下可制得11.2 L的Cl2
C. 实验①生成的气体能使湿润的淀粉KI试纸变蓝
D. 实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,其中每个数字编号代表对应的一种元素.

请按要求回答下列问题:
(1)画出元素②的原子结构示意图_____________________.
(2)属于稀有气体的元素编号是________________,可作半导体材料的元素编号是_________________.
(3)③、⑦两种元素相比较,非金属性强的是__________________(填元素符号).
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是__________,______.
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式:_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应,在一定条件下,反应物至少有一种能完全反应的是
A. 过量的氢气与氮气 B. 过量的二氧化锰与浓盐酸
C. 过量的铜与浓硫酸 D. 过量的锌与18 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. 水玻璃、双氧水、漂粉精、硅胶都是混合物
C. 直径在10-9 ~ 10-7mNaCl固体小颗粒分散到水中能形成胶体
D. “陶成雅器”的主要原料是黏土
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.液态HCl不导电,但HCl属于电解质
B.NaHSO4溶于水电离出Na+、H+ 和SO42-,所以NaHSO4属于酸
C.氢氧化铁胶体和食盐水都属于混合物
D.Al(OH)3可用作胃酸中和剂,不会对胃壁产生强烈刺激
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
![]()
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .

(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯可在金属锡、盐酸作用下生成氯化苯铵盐(![]() )、氯化亚锡(SnCl2)和水。
)、氯化亚锡(SnCl2)和水。
(1)写出Sn2+的最外层电子排布式___________;Cl-中有_________个填充电子的能级。
(2)画出硝基的电子式____________,氯化亚锡分子的空间构型是________________;氯化苯胺盐(![]() )中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
)中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
(3)Sn的一种同素异形体——灰锡的晶体结构类似金刚石,立方晶胞结构如图所示,则锡的配位数是_______。

(4)假设锡原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,计算灰锡的空间利用率约为________________。(百分数表示,取两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3(g)![]() C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
C6H5-CH=CH2(g) +H2(g)ΔH=a kJmol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:

600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g)![]() C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。

(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com