
 .
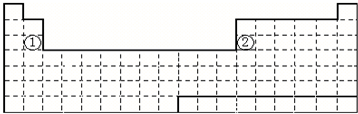
.分析 (1)元素周期表按照电子排布,可以分为s、p、d、ds、f等五个区,其中s区和p区即含有金属元素又含有非金属元素,d、ds、f区均只含有过渡金属元素;
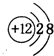
(2)图表中①号元素为Mg元素,原子序数为12,核外电子排布式为:[Ne]3s2,②号元素为13号元素Al,故其核外电子排布式为:[Ne]3s23p1;
同周期自左而右原子半径减小、电负性增大、金属性减弱;
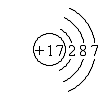
(3)短周期元素最高正价为+7则该元素为Cl;
(4)氢元素最高正价与最低负价的绝对值相等,性质和第ⅣA族各元素相同,故可放在第ⅣA族,将氢元素放在第ⅦA族,主要是因为H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H.
解答 解:(1)画出金属元素与非金属元素的分界线为: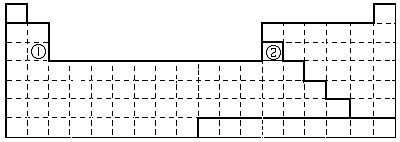
元素周期表按照电子排布,可以分为s、p、d、ds、f等五个区,其中s区和p区即含有金属元素又含有非金属元素,d、ds、f区均只含有过渡金属元素;
故答案为:
(2)图表中①号元素为Mg元素,原子序数为12,核外电子排布式为:[Ne]3s2,最外层电子排布为3s2;②号元素为13号元素Al,故其核外电子排布式为:[Ne]3s23p1,故最外层电子排布为3s23p1;两元素的原子电子层数相同,核电荷数Al>Mg,故其原子半径Mg>Al;电负性:Mg<Al,金属性:Mg>Al,
故答案为:3s2;3s23p1;>;<;>;
(3)短周期元素最高正价为+7则该元素为Cl,与按结构示意图为:
故答案为:
(4)氢元素最高正价与最低负价的绝对值相等,性质和第ⅣA族各元素相同,故可放在第ⅣA族,将氢元素放在第ⅦA族,主要是因为H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H,
故答案为:IVA;H原子得到一个电子实现最外电子层稳定结构、氢分子的结构式为H-H.
点评 本题考查元素周期表与元素周期律,注意掌握元素周期表的结构,识记族与列的关系,理解同主族原子序数关系.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
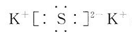 ,A属于离子化合物.
,A属于离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
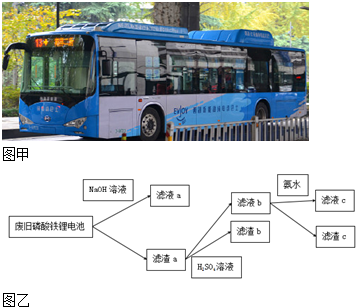
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2与所有的酸都不能发生反应 | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | 过量的铜与浓硝酸反应能生成NO气体 | |
| D. | 加盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
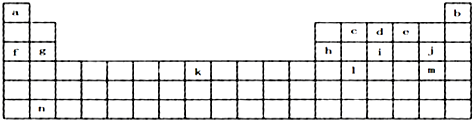
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com