
分子式为CnH2nO2的羧酸和某醇酯化生成分子式为Cn+2H2n+4O2的酯,参加反应的羧酸和醇的质量比为1∶1,则该羧酸是
A.乙酸 B.丙酸 C.甲酸 D.乙二酸
科目:高中化学 来源: 题型:
在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是 ( )
A.pH增大,HClO浓度增大
B.pH减小,Cl-浓度增大
C.pH增大,Cl-浓度减小
D.pH减小,HClO浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
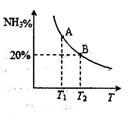 ①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:

①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
查看答案和解析>>
科目:高中化学 来源: 题型:

 A物质为重要的有机化合物,可以发生如下所示的一系列反应。
A物质为重要的有机化合物,可以发生如下所示的一系列反应。
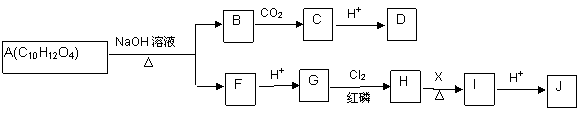

已知:①A分子中苯环上有两个对位的取代基;可以与碳酸氢钠反应生成二氧化碳。
②
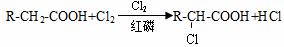
③F的分子式为C3H5O2Na。
请回答下列问题:
(1)可选用__________(填试剂名称)检验C物质中的其中一种官能团。
(2)I分子结构中含有碳碳双键,则试剂X为________ 。
(3)J可以发生的反应类型有__________(填序号)
a.消去反应 b.酯化反应 c.加聚反应 d.缩聚反应
(4)A与加热时与足量NaOH水溶液反应的化学方程式为
_______________________ 。
(5)K满足以下条件:
①与A物质为同系物,且比A分子少一个C原子;
②苯环上两个取代基在对位,能与银氨溶液发生银镜反应;
③相同物质的量的K和A与NaOH溶液反应,消耗NaOH的量相同。
则K的结构简式为_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是①用98%的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水 ⑥加入少量硫酸铜
A.全部 B.②③⑥ C.①②③⑥ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式为 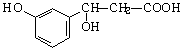 ,它可以发生的反应类型有
,它可以发生的反应类型有
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A.①②③④ B.①②④⑤ C.①②⑤⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最节能的是________(填字母序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢: 2H2O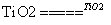 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O 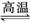 CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为______________________。
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:
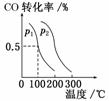 CO(g)+2H2(g)
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1________p2(填“<”、“>”或“=”),上述反应的ΔH________0(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验装置能完成相应实验的是 ( )

C.装置③制备纯净的NH3 D.装置④比较MnO2、Cl2、S的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
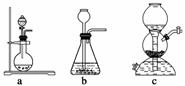
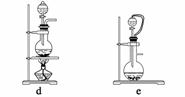
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠________g(保留一位小数);如果已有40%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠________g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰石膏法和碱法是常用的烟气脱硫法。
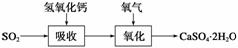
石灰石膏法的吸收反应为SO2+Ca(OH)2―→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O―→2CaSO4·2H2O。其流程如下图:
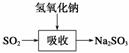
碱法的吸收反应为SO2+2NaOH―→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰石膏法和碱法吸收二氧化硫的化学原理相同之处是
________________________________________________________________________。
和碱法相比,石灰-石膏法的优点是_______________________________________,
缺点是__________________________________________________________________。
(4)在石灰石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com