
分析 (1)设两溶液体积都为VL,根据c=nV计算出硫酸铁的物质的量,再根据硫酸铁的化学式计算铁离子的物质的量,最后根据c=$\frac{n}{V}$计算出混合液中铁离子的物质的量浓度;
(2)2.0 mol/L H2SO4溶液中H+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合后c(H+);
根据n=cV计算出硫酸铁、硫酸的物质的量,再根据化学式计算出硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出混合液中SO42-的物质的量浓度;
(3)三价铁离子氧化性强于氢离子,混合物中加入铁,先与三价铁离子反应,剩余铁再与氢离子反应生成氢气,依据方程式:Fe+2Fe3+=3Fe2+,
Fe+H2SO4=FeSO4+H2↑,计算解答.
解答 解:(1)设混合液体积为2VL,VL 2.0mol/L的硫酸铁溶液中含有硫酸铁的物质的量为:2.0mol/L×VL=2Vmol,2Vmol硫酸铁中含有4Vmol铁离子,混合液中铁离子的浓度为:c(Fe3+)=$\frac{4Vmol}{2VL}$=2 mol/L,
答:混合液中Fe3+的物质的量浓度为2mol/L;
(2)2.0 mol/L H2SO4溶液中H+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,则等体积混合后,溶液中H+的物质的量浓度c(H+)=$\frac{1}{2}$×4mol/L=2mol/L.
设混合液体积为2VL,2.0 mol/L H2SO4VL溶液中含有硫酸的物质的量为:2.0mol/L×VL=2Vmol,2Vmol硫酸能够电离出2Vmol硫酸根离子,2Vmol硫酸铁中含有6Vmol硫酸根离子,则混合液中硫酸根离子浓度为:c(SO42-)=$\frac{2Vmol+6Vmol}{2VL}$=4 mol/L,
答:混溶液中H+的物质的量浓度为2mol/L;SO42-的物质的量浓度为4mol/L;
(3)将2.0mol/LFe2(SO4)3溶液和2.0mol/LH2SO4等体积混合,混和后的溶液为2L,则含有三价铁离子的物质的量为:2.0mol/L×2×1L=4mol,依据方程式:Fe+2Fe3+=3Fe2+,可知消耗铁物质的量为2mol,剩余铁与硫酸反应生成氢气标准状况下的体积为16.8L,物质的量为:$\frac{16.8L}{22.4L/mol}$=0.75mol,依据方程式:Fe+H2SO4=FeSO4+H2↑,可知消耗铁物质的量为0.75mol,共消耗铁物质的量为2mol+0.75mol=2.75mol,质量为:2.75mol×56g/mol=154g;
答:加入铁粉的质量为154g.
点评 本题考查物质的量浓度的计算,涉及定义法、稀释定律、电荷守恒、元素守恒等方法,难度中等,注意守恒思想的运用,注意氧化还原反应强弱规律的应用.


科目:高中化学 来源: 题型:解答题
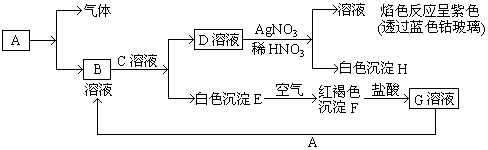
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使品红溶液褪色 | B. | 能使石蕊试液先变红再褪色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
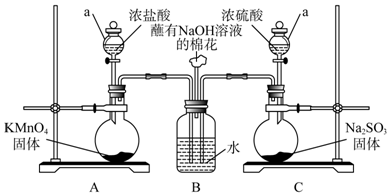
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
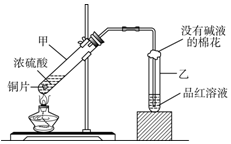 用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.
用如图所示的装置可以验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-总数为0.1NA | |
| B. | 16g16O2和18g18O2中含有的质子数均为8NA | |
| C. | 1molFe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水所得溶液中含有的氯离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com