
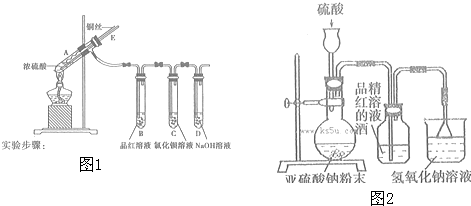
分析 I.(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2、H2O,根据反应物、生成物和反应条件书写方程式;
(2)SO2具有还原性,能被强氧化剂氧化生成硫酸,据此写出二氧化硫与氯气反应的离子方程式;
(3)A中气体和外界相通,能利用大气压平衡A中压强;
(4)SO2有毒,为防止SO2污染空气,应该将装置中气体全部通入NaOH溶液中,使SO2被完全吸收;
(5)SO2具有氧化性,能和Na2S反应生成S单质,当吸收二氧化硫最多时生成亚硫酸氢钠和S,反应方程式为5SO2+2Na2S+2H2O=3S↓+4NaHSO3,根据二者之间的关系式计算;
II.(1)根据浓硫酸和二氧化硫的性质分析,浓度大时硫酸以分子形式存在,硫酸稀时,二氧化硫易溶于水,据此分析.
(2)根据实验目的及二氧化硫的性质分析,应制取干燥的二氧化硫气体,为控制液体的量,应选取易控制流量的仪器;
(3)根据二氧化硫、品红溶液、品红酒精溶液的性质分析;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,根据溶液中存在的含硫微粒判断.
解答 解:(1)加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2、H2O,根据反应物、生成物和反应条件知,该反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)SO2具有还原性,能被强氧化剂氧化生成硫酸,Cl2具有强氧化性,在水溶液里能将SO2氧化为硫酸,硫酸和BaCl2溶液发生复分解反应生成BaSO4,离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42-、Ba2++SO42-=BaSO4↓,
故答案为:Cl2+SO2+2H2O=4H++2Cl-+SO42-、Ba2++SO42-=BaSO4↓;
(3)当A中气体压强减小时,外界大气压不变,空气从E进入A,使A中压强平衡,所以B中压强不会产生倒吸,
故答案为:当A试管中气压减小时,空气从E导管进入A中,维持A中气压平衡;
(4)SO2有毒不能直接排空,为防止SO2污染空气,应该将装置中气体全部通入NaOH溶液中,使SO2被完全吸收,其基本操作方法为从E管口向A中缓缓鼓入足量空气,将残留的二氧化硫赶入NaOH溶液中,使其完全被吸收,
故答案为:从E管口向A中缓缓鼓入空气将残留的SO2赶入NaOH中充分吸收;
(5)SO2具有氧化性,能和Na2S反应生成S单质,当吸收二氧化硫最多时生成亚硫酸氢钠和S,反应方程式为5SO2+2Na2S+2H2O=3S↓+4NaHSO3,设最多吸收的二氧化硫物质的量为x,
5SO2+2Na2S+2H2O=3S↓+4NaHSO3,
5mol 2mol
x 2mol
5mol:2mol=x:2mol
x=$\frac{5mol×2mol}{2mol}$=5mol,
故答案为:5;
II.(1)硫酸和亚硫酸钠固体制取二氧化硫发生的是离子反应,如果硫酸浓度过大,硫酸是以分子形式存在,没有电离出H+,不能反应生成SO2;如果硫酸浓度过低,二氧化硫易溶于水,不利于二氧化硫放出,所以选取70%硫酸,故选B,
故答案为:B;
(2)为控制硫酸的流量应选取分液漏斗,该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥,
故答案为:不能用长颈漏斗,应改用分液漏斗;缺少二氧化硫的干燥装置;
(3)二氧化硫和水反应生成亚硫酸,二氧化硫和酒精不反应,二氧化硫能使品红溶液褪色而不能使品红的酒精溶液褪色,由此得出S02的漂白作用是SO2与水作用的产物导致的,二氧化硫和水反应生成亚硫酸、亚硫酸电离生成亚硫酸氢根离子、亚硫酸氢根离子电离生成亚硫酸根离子,所以使品红的水溶液褪色的微粒可能是:HSO3-、SO32-、H2SO3,
故答案为:HSO3-、SO32-、H2SO3;
(4)亚硫酸钠和亚硫酸氢钠都能水解生成亚硫酸,且亚硫酸氢根离子能电离生成亚硫酸根离子,所以两种溶液中都含有HSO3-、SO32-、H2SO3,所以不能确定使品红褪色的微粒肯定是HSO3-或SO32-,
故答案为:不正确;因为亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及浓硫酸的性质、二氧化硫的漂白性探究、化学实验基本操作方法判断等知识,试题知识点较多、题量较大,注意掌握性质实验方案的设计原则,试题有利于提高学生的分析、理解能力及化学实验能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
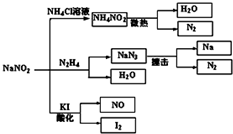 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )| A. | 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) | |
| B. | N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 | |
| C. | NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4═NaN3+2H2O | |
| D. | 如图所涉及到的化学反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 H2C2O4溶液:C(H+)>C(H2C2O4)>C(H2C2O4-)>C (C2O42-) | |
| B. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后所得溶液的PH<7 | |
| C. | 在(NH4)2SO4溶液中,C(NH4+)+C(NH3•H2O)=$\frac{1}{2}$C(SO42-) | |
| D. | 叠氮酸(HN3)与醋酸性相似,0.1 mol•L-1NaN3溶液:C (N3-)>C(Na+)>C(OH-)>C (H+) |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有漂白性 |
B | C2H5OH与浓硫酸混合后加热到170℃ | 生成的气体使酸性KMnO4溶液褪色 | 反应一定生成了乙烯 |
C | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊 | 试纸变为蓝色 | NO3-被还原为NH3 |
D | 向NaSiO3溶液中滴加I滴酚酞试液,然后逐滴加入稀盐酸至红色褪去 | 产生胶装沉淀 | 非金属性:Cl>Si |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:实验题
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
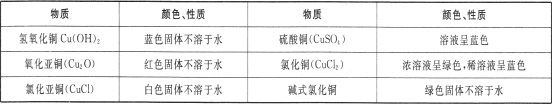
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗 涤、干燥,连接下列装置进行实验,验证阴极产物,
涤、干燥,连接下列装置进行实验,验证阴极产物,
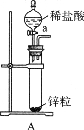
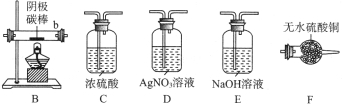
①实验前,检查装置A气密性的方法是。
②实验 时,各装置从左至右的连接顺序为A→→→B→→。
时,各装置从左至右的连接顺序为A→→→B→→。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是;②装置(填上图中装置编号)中的现象说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成→消去→取代 | B. | 消去→加成→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
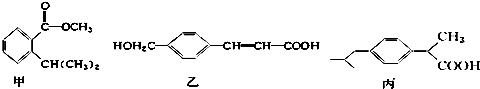
| A. | 甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应 | |
| B. | 只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙 | |
| C. | 与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3:4:3 | |
| D. | 甲的化学式为C11H14O2,乙含有两种含氧官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
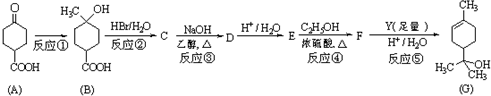
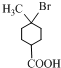 +2NaOH
+2NaOH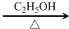
 +NaBr+2H2O.
+NaBr+2H2O.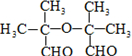 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com