
【题目】17.1 g物质A在氧气中充分燃烧有白雾现象,产物有三种,其中CO2和H2O的质量比为44:9。将等质量的A与钠混合熔融,把产物溶于足量稀硝酸后,加入足量AgNO3溶液,得到18.8 g淡黄色沉淀。物质A的蒸气对相同条件下氢气的相对密度为85.5。已知它不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。写出A的结构简式。______________
科目:高中化学 来源: 题型:
【题目】二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
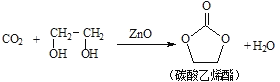
回答下列问题:
(1)锌基态离子的价电子排布图为_______________;在基态18O原子中,核外电子存在_________种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol 碳酸乙烯酯中含有的σ键的数目为__________NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________(填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为____________ (填序号) a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为 ____________ 。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→___→___→___→___→___→___→h
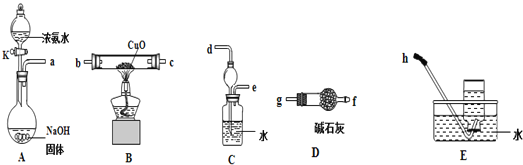
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为_____________________。
③装置C中的球形装置的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中数据,下列判断正确的是( )

A. 在等浓度的NaF、NaH2PO4混合溶液中:c(Na+) + c(H+)=c(F-) + c(H2PO4-) + c(OH-)
B. 少量H3PO4和NaF反应的离子方程式为:H3PO4 +2F-===HPO42-+2HF
C. 同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4
D. 结合质子能力:PO43->HPO42->F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.化学用语具有简便、确切地表达化学知识和化学科学思维的特点.下列化学用语中书写正确的是( )
A. N2的电子式:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型 :![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示,其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
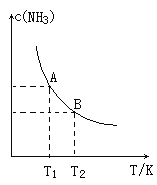
①该反应的焓变△H__0(填“>”或“<”)判断依据为_____。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______。
③T1温度下该反应的化学平衡常数K1=______。
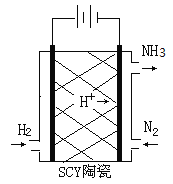
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
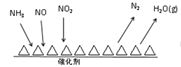
①SCR技术中的氧化剂为__________________。
②当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______________。当有3 mol电子发生转移时,则参与反应的NO的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3-、Na+、Ba2+、NO3-等4种离子,若向其中加入少量的Na2O2固体后溶液中离子浓度基本保持不变的是
A.HCO3-B.NO3-C.Ba2+D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物结构的说法错误的是( )
A.一氯乙烷有两种同分异构体B.苯分子中六个碳碳键键长完全相等
C.乙烯分子中所有原子处于同一平面内D.乙醇的核磁共振谱图中有3个特征峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com