
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
分析 A.依据离子反应条件判断;
B.亚铁离子与硝酸发生氧化还原反应生成NO,溴离子与银离子反应生成AgBr;
C.气体状况未知;
D.氯气过量,二价铁离子、溴离子全部被氧化.
解答 解:A.离子之间不反应,且与FeBr2不反应,则离子之间可大量共存,该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存,故A正确;
B.亚铁离子与硝酸发生氧化还原反应生成NO,溴离子与银离子反应生成AgBr沉淀,则反应有沉淀生成并放出气体,故B正确;
C.气体状况未知,无法计算氯气的物质的量,故C错误;
D.向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D正确;
故选:C.
点评 本题为综合题,考查了阿伏伽德罗常数的使用与计算,离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X=Y=Z | B. | X=Y<Z | C. | X>Y=Z | D. | X<Y=Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离除去溴苯中混入的溴 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 石油的裂解是化学变化,而石油的分馏和煤的干馏是物理变化 | |
| D. | 结构简式为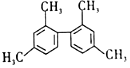 的分子中至少有11个碳原子处于同一平面上 的分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
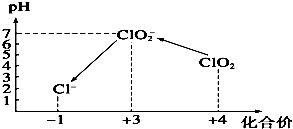 ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+═Cu2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 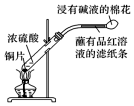 制取SO2并检验SO2的漂白性 | B. | 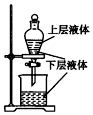 提取海带中的碘 | ||
| C. | 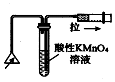 检验火柴燃烧产生的SO2 | D. | 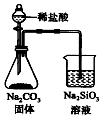 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸的摩尔质量是90g/mol | |
| B. | 1mol草酸中含有6.02×1023个分子 | |
| C. | 45g草酸中含有1.204×1024个氧原子 | |
| D. | 1mol草酸在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4NA | |
| B. | 300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | |
| C. | 在常温常压下,17 g硫化氢所含质子数目为8 NA | |
| D. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com