
| A. | CO2 | B. | O2 | C. | HCl | D. | Cl2 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力增强 | |
| B. | 配制FeCl3溶液,可加入少量的稀硫酸,以防止溶液浑浊 | |
| C. | 加热蒸干Al2(SO4)3溶液,最终能得到Al2(SO4)3晶体 | |
| D. | 利用明矾净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀,铁与水蒸气在高温下的反应产物为Fe3O4和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图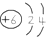 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式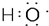 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
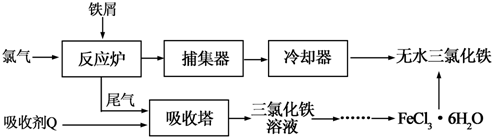
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com