
 Zn
Zn  +H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为:W2++2e-=W,Y=Y2++2e-。可知X、Y、Z、W的还原性由强到弱的顺序是( )
+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为:W2++2e-=W,Y=Y2++2e-。可知X、Y、Z、W的还原性由强到弱的顺序是( )| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>Y>X>W | D.Z>X>Y>W |
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题







| A.全部 | B.全不正确 | C.④⑤ | D.①②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
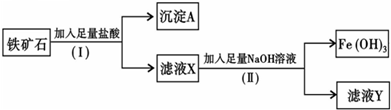
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
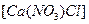 是一种混盐,硫酸铝钾
是一种混盐,硫酸铝钾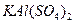 是一种复盐,冰晶石(六氟合铝酸钠)
是一种复盐,冰晶石(六氟合铝酸钠)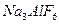 是一种络盐。对于组成为
是一种络盐。对于组成为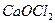 的盐可归类于
的盐可归类于
| A.混盐 | B.复盐 |
| C.络盐 | D.无法归属于上述类别 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pH=1。
pH=1。| A.2.352L | B.2.448L | C.2.688L | D.2.856L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com