
| A、保持恒容,平衡后再降低温度,平衡常数减小 |
| B、若增加F2的用量,平衡正向移动,则反应物的转化率均增大 |
| C、达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D、恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8 |
| 0.4mol+0.6mol+0.6mol |
| 2mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
| A、正戊烷的燃烧热大约是3540kJ/mol |
| B、热稳定性:正丁烷>异丁烷 |
| C、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ/mol |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④②⑥③⑤ |
| B、①⑤②⑥④③ |
| C、①②④⑤③⑥ |
| D、①④②⑥③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl和HCl |
| B、NH2OCl和HCl |
| C、NH3和HClO |
| D、NH3?H2O和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是( )
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是( )| A、X可能是一种氢化物 |
| B、F中M元素的化合价可能为+5 |
| C、E可能是一种有色气体 |
| D、若X为单质,Y生成Z属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用淀粉为原料生产酒精(酿酒) |
| B、甲烷与氯气制备一氯甲烷 |
| C、乙烯聚合为聚乙烯高分子材料 |
| D、以油脂为原料生产肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
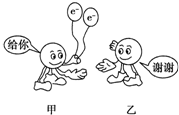 如图为反应3Cu+8HNO3(稀)=3Cu(NO3)3+2NO↑+4H2O中电子转移的关系图,则图中的元素甲、乙分别表示( )
如图为反应3Cu+8HNO3(稀)=3Cu(NO3)3+2NO↑+4H2O中电子转移的关系图,则图中的元素甲、乙分别表示( )| A、Cu,O | B、Cu,H |
| C、H,O | D、Cu,N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡常数与温度无关 |
| B、两种物质反应,不管怎样书写化学方程式,平衡常数不变 |
| C、化学平衡常数等于某时刻生成物浓度幂之积与反应物浓度幂之积的比值 |
| D、温度一定,对于给定的化学反应,正逆反应的平衡常数互为倒数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com