
【题目】某同学用胆矾晶体(CuSO4·5H2O)配制0.040mol/L的CuSO4溶液240mL,回答下列问题:
(1)所需仪器为:托盘天平、药匙、烧杯、量筒、胶头滴管,还需要哪些玻璃仪器才能完成该实验?请写出:__________。
(2)请写出该实验的简要的实验步骤:
①计算②称量胆矾_________g③_________④转移⑤洗涤并转移⑥定容⑦摇匀
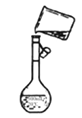
(3)下图是该同学转移溶液的示意图,图中的错误是________。
(4)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响_________(填“偏高”、“偏低”或“无影响”)。
(5)另有一瓶配制好的CuCl2溶液,因时间过长,标签污损,为检验它就是盛有CuCl2溶液,请写出实验操作及现象。
鉴别对象 | 实验操作、现象 |
Cu2+ | |
Cl- |
【答案】(1)250mL容量瓶、玻璃棒(每项正确得1分,共2分)
(2)②2.5(1分)③溶解(或溶解并恢复至室温)(1分)
(3)转移溶液时不能直接倾倒,应用玻璃棒引流(1分)
(4)偏低(1分)
(5)
鉴别对象 | 实验操作、现象 |
Cu2+ | 取少量待测溶液于试管中,滴入几滴NaOH溶液(1分), 有蓝色沉淀生成(1分)。 |
Cl- | 取少量待测溶液于试管中,加入稀硝酸酸化(1分), 再滴入几滴硝酸银溶液,有白色沉淀生成(1分)。 |
【解析】试题分析:(1)所需仪器有一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀。所以所需仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,根据提供的仪器可知,还需要的仪器有250mL容量瓶、玻璃棒。
(2)该实验的简要的实验步骤:①计算;②称量胆矾m=0.25L×0.04molL-1×250g/mol=2.5g;③溶解;④转移; ⑤洗涤并转移;⑥定容 ⑦摇匀。
(3)图中的错误为转移溶液时不能直接倾倒,应用玻璃棒引流。
(4)定容后再加蒸馏水,会使溶液体积偏大,所配溶液浓度偏低。
(5)根据Cl-、Cu2+的检验方法设计实验如下:
鉴别对象 | 实验操作、现象 |
Cu2+ | 取少量待测溶液于试管中,滴入几滴NaOH溶液, 有蓝色沉淀生成。 |
Cl- | 取少量待测溶液于试管中,加入稀硝酸酸化, 再滴入几滴硝酸银溶液,有白色沉淀生成。 |


科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂粉精久置空气中会变质,在变质过程中不会涉及的性质是( )
A. H2CO3 的酸性 B. HClO 的不稳定性
C. HClO 的弱酸性 D. HClO 的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成
(1)(写出电离方程式)Fe2(SO4)3 ;
(2)用单线桥表示2Al+3CuSO4=3Cu+Al2(SO4)3
(3)用双线桥表示Fe2O3+3CO=2Fe+3CO2
(4)配平KMnO4+H2S+H2SO4=MnSO4+K2SO4+H2O
(5)配平Fe(足量)+NO3-+H+=Fe2++NO↑+H2O
(6)CO32—+2H+=CO2↑+H2O(写出对应的化学方程式) ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A.单质分子均不存在化学键
B.共价化合物中一定含有共价键,也可能含有离子键
C.含有共价键的化合物一定是共价化合物
D.离子化合物中一定含有离子键,也可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是( )
①溴乙烷与氢氧化钠水溶液共热 ②溴乙烷与氢氧化钠的乙醇溶液共热
③甲烷与氯气 ④乙炔与氯化氢在一定条件下制氯乙烯
A.①② B.②④ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于吸热反应的分析正确的是( )
A.生成物化学键形成时也会吸收热量
B.生成物的总能量高于反应物的总能量
C.一定需要加热条件下才能实现
D.使用催化剂可以降低吸热反应的热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。
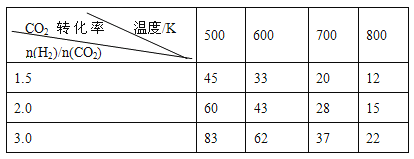
根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com