
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确
的是_________(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=______________________
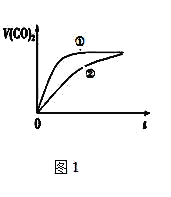
⑶常温下,将20mL 0.1 mol/L CH3COOH溶液 和20mL 0.1 mol/L HNO2 溶液分别与 20mL 0.1 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是_______(填写序号);反应结束后所得两溶液中,c(CH3COO-)________c(NO2-)(填“>”、“<”或“=”);
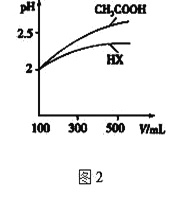
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数_________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
【答案】 a d 18 ② < 小于 1.8×10-5
【解析】(1)向0.1molL-1CH3COOH 溶液中加入少量CH3COONa 晶体时;a.醋酸钠电离生成的醋酸根离子抑制醋酸电离,所以溶液的酸性减弱,pH增大,故a正确;b.醋酸钠电离出醋酸根离子导致溶液中醋酸根离子浓度增大,则抑制醋酸电离,所以CH3COOH的电离程度减小,故b错误;c.醋酸钠是强电解质,完全电离,所以溶液中离子浓度增大,则溶液的导电能力增强,故c错误;d.溶液中c(OH-).c(H+)=Kw,Kw只受温度影响,温度不变所以Kw不变,故d正确;故答案为ad;
(2)混合液中![]() =18;
=18;
(3)亚硝酸电离平衡常数大于醋酸,所以相同浓度的醋酸和亚硝酸中,亚硝酸中氢离子浓度大于醋酸,所以亚硝酸反应速率大于醋酸,制取相同体积的二氧化碳,亚硝酸需要的时间短,所以②是醋酸反应曲线;反应结束后,醋酸根离子水解程度大于亚硝酸根离子,所以溶液中存在c(CH3COO-)<c(NO2-);
(4)pH相同的一元弱酸,加水稀释促进弱酸电离,加水稀释相同的倍数时pH变化越小的酸越弱,根据图知,稀释相同的倍数时HXpH变化小于醋酸,所以HX酸性小于醋酸,则HX的电离平衡常数小于CH3COOH的电离平衡常数;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,二者恰好完全反应生成醋酸铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相同,则醋酸电离平衡常数等于一水合氨电离平衡常数为1.8×10-5。


科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在,丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸H2C2O4![]() HC2O4-+H+,Ka1;HC2O4-
HC2O4-+H+,Ka1;HC2O4-![]() C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B. pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,最适合的氧化剂是
A. Cl2水溶液 B. KMnO4溶液 C. H2O2水溶液 D. HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离和鉴别方法正确的是( )
A.用分液法分离碘酒和CCl4
B.用饱和碳酸钠溶液萃取乙醇中的乙酸
C.用银氨溶液鉴别甲酸乙酯和乙醛
D.用浓溴水鉴别苯和环己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能将已烯、已烷、乙醇、乙酸、乙醛、苯酚、硝酸银溶液7种物质鉴别开来的试剂组是
A.氯化铁溶液、烧碱溶液、金属钠
B.烧碱溶液、紫色石蕊试液
C.新制Cu(OH)2悬浊液、紫色石蕊试液
D.新制Cu(OH)2悬浊液、溴水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com