
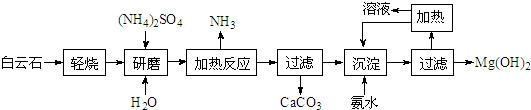
| ||
| 实际量 |
| 理论量 |
| ||
| ||
| 5.8×106 |
| 5.8×106+1.5×10-4×200×103×58g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、含18个中子的氯原子的核素符号:
| ||
B、比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:
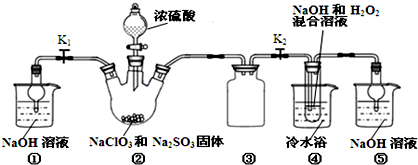
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
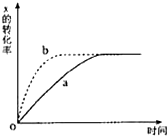 如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进
如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进| A、升高温度 |
| B、加大N的投入量 |
| C、缩小体积 |
| D、加大X的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
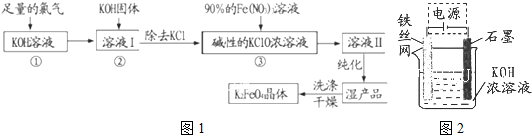
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
| A、若甲为C2H5OH,则丙可能为CH3COOH |
| B、若涉及反应均为氧化还原反应,则甲可能为Cl2 |
| C、若涉及反应均为氧化还原反应,则丁可能为O2 |
| D、若甲为AlCl3溶液,则丁可能是NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com