
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2 + 4Fe3+ ![]() Cu2+ + 5Fe2+ + 2S。
Cu2+ + 5Fe2+ + 2S。
(1)该反应中,Fe3+体现________性。
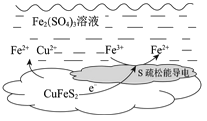
(2)上述总反应的原理如图所示。
负极的电极反应式是________。
(3)一定温度下,控制浸取剂pH = 1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,再加入少量0.0005 mol·L-1 Ag2SO4溶液 | 98.0 |
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+==Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+==2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005 mol·L-1 Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________,证明发生反应i。
b.取少量Ag2S粉末,加入________溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
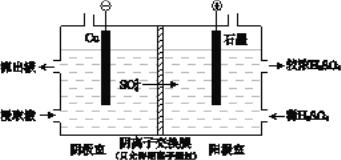
① 电解初期,阴极没有铜析出。用电极反应式解释原因是_______________。
② 将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 _____________________。
【答案】 氧化 CuFeS2 - 4e-== Fe2+ + 2S + Cu2+ 通入O2后,Fe2+ 被氧化为Fe3+,c(Fe2+)降低,c(Fe3+)升高,平衡正向移动 无明显现象 Fe2(SO4)3溶液 Fe3+ + e-== Fe2+ Fe2+在阳极失电子生成Fe3+ , SO42- 通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生
【解析】(1)本题考查氧化还原反应中的几个概念,根据离子反应方程式,Fe3+→Fe2+,化合价降低,因此Fe3+表现氧化性;(2)本题考查原电池的电极反应式的书写,根据原电池的工作原理,失电子的一极为负极,因此CuFeS2作负极,其电极反应式为CuFeS2-4e-=Fe2++2S+Cu2+;(3)考查影响化学反应速率和化学平衡移动的因素,①根据氧气把Fe2+氧化成Fe3+,根据上述反应方程式,减少c(Fe2+),促使平衡向正反应方向移动;②a、根据反应方程式,取上层清液,加入稀盐酸,没有沉淀产生,说明溶液中不含Ag+,即说明i发生;b、根据ii反应,需要加入Fe2(SO4)3溶液;(4)本题考查电极反应式的书写,①实验II中,加入过量Fe2(SO4)3溶液,Fe3+过量,因为Fe3+的氧化性强于Cu2+,因此Fe3+先放电,即Fe3++e-=Fe2+;②阳极上发生Fe2+-e-=Fe3+,Fe2+在阳极失电子生成Fe3+ , SO42- 通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生。


科目:高中化学 来源: 题型:
【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的、酸性溶液中,能共存的离子组是( )
A.Na+ 、K+、SO42-、CO32-B.Na+、 K+、Cl、 NO3
C.Cu2+、K+、SO42-、NO3D.Ba2+、K+、Cl、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘具有“智力元素”之称.体内缺碘会影响神经系统发育,造成智力损害.食用碘盐可以防止碘缺乏病.碘盐中加入的物质是( )
A.I2
B.KI
C.KIO3
D.NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述不正确的是 ( )

A. 碳[C(s)]的燃烧热△H< -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O吸收73kJ的热量
C. 2Cu2O(s)+O2(g)=4CuO(s) △H=-292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= -35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是
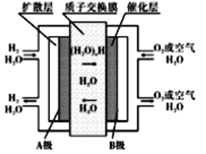
A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com