
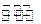 CH3OH��g�����й����е������仯���ߡ����� a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������ b��ʾʹ�ô�����������仯���������˵����ȷ���� �� ��
CH3OH��g�����й����е������仯���ߡ����� a��ʾ��ʹ�ô���ʱ��Ӧ�������仯������ b��ʾʹ�ô�����������仯���������˵����ȷ���� �� ��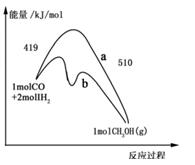
| A�������������䣬������ b�߽��еķ�Ӧ�� CH3OH�IJ��ʸ��� | |
| B�������������䣬�ֱ����� a��b�߽��еķ�Ӧ����ЧӦ��ͬ | |
C����1molCO + 2molH2���еļ���֮�ͱ� 1molCH3OH�еļ���֮�ʹ�  | D���Ȼ�ѧ����ʽΪ CO��g��+2H2��g�� CH3OH��g�� ��H=-91kJ��mol-1 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ȷ�Ӧ�ڲ����ȵ�������һ�����ܷ��� |
| B�����ȷ�Ӧ�ڳ�����һ���������� |
| C���ɡ�C��ʯī��= C�����ʯ������H=" +119" kJ/mol ��֪ʯī�Ƚ��ʯ�ȶ� |
| D����ѧ��Ӧ�е������仯��ֻ����Ϊ���ܵı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B������ |
| C�����ᣨHOOC-COOH�� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ȶ��ԣ�Na2CO3 >NaHCO3 | B���ܽ�ȣ�Na2CO3<NaHCO3 |
| C�������ᷴӦ�����ʣ�Na2CO3 <NaHCO3 | D����Է�������Na2CO3 >NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����֪2H2(g)��O2(g)��2H2O(l)��H����483.6 kJ�� mol�C1�� ��������ȼ����Ϊ483.6kJ�� mol�C1  |
| B����֪2C(s)��2O2(g)��2CO2(g) ��H12C(s)��O2(g)��2CO(g)��H2�� ���H1����H2 .m  |
| C����֪C(ʯī��s)��C(���ʯ��s)��H��0������ʯ��ʯī�ȶ� |
| D����֪Ni(CO)4(s)��Ni(s) + 4CO(g)��H��0����÷�Ӧ���κ������¾������Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
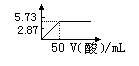
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 (l)��O2(g) ��H= ��196.46kJ��mol��1
(l)��O2(g) ��H= ��196.46kJ��mol��1| A��ͭ�����ܽ���ϡ������H2O2�Ļ����Һ |
| B��ͭ�ܽ�������˫��ˮ���Ȼ�ѧ����ʽΪ�� Cu(s)+H2O2(l)+2H��(aq)=Cu2��(aq)+2H2O(l) ��H= ��319.68 kJ��mol��  1 1 |
| C����Ӧ�������κ������¶������ܷ����Ļ�ѧ��Ӧ |
| D����H2O2��H2SO4�Ļ����Һ�ܽ�ͭ����Ũ�����ܽ�ͭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ϡ������0.1mol/LNaOH��Һ��Ӧ��H��(aq)��OH��(aq)=H2O (l) ����H=-57.3KJ/mol |
| B������������Һ�м������������Һ��Fe2+��H2O2��2H+= Fe3+��2 H2O |
| C����Ba(OH)2��Һ���ϼ��뵽KAl(SO4)2��Һ�У���Ӧ���������ʵ������ 3Ba2+��6OH����2Al3+��3SO42��=3BaSO4����2 Al(OH)3�� |
| D���Ȼ�����Һ�м������Ũ��ˮ��Al3+��4NH3��H2O = 2AlO2����4NH4����2 H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com