
| A. | A、B、C、D的浓度相等 | B. | A、B、C、D在密闭容器中共存 | ||
| C. | A、B、C、D的浓度不再变化 | D. | A消耗的速率与C消耗的速率相等 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、A、B、C、D的浓度不变,而不是相等,故A错误;
B、任意时刻都是A、B、C、D在密闭容器中共存,故B错误;
C、A、B、C、D的浓度不再变化,说明正逆反应速率相等,达平衡状态,故C正确;
D、A消耗的速率与C消耗的速率相等,不等于计量数之比,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
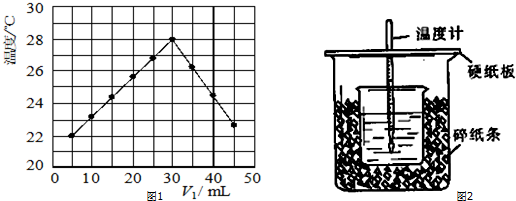
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
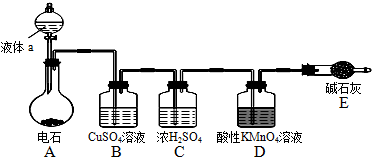
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
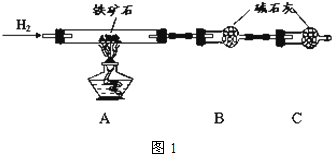 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4. | D. | 离子半径:N3->O2->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | Mg2+、K+、NO3-、Cl- | ||
| C. | Na+、Fe2+、NO3-、Cl- | D. | Ba2+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的铜-锌原电池中,
如图所示的铜-锌原电池中,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com