
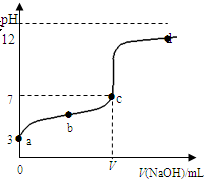
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
(1)酚酞(1分)
(2)Ac—+H2O  HAc+OH—、H2O
HAc+OH—、H2O H++OH-、c(Na+)>c(A-)> c(OH-) > c(H+)(各1分)
H++OH-、c(Na+)>c(A-)> c(OH-) > c(H+)(各1分)
(3)c>b>a>d(2分)
(4)(10—7·V)/(20—V)(2分)
解析试题分析:(1)由图像可知,用强碱滴定该酸的时候pH突变范围为7~11左右,可见该酸为弱酸,生成的盐为强碱弱酸盐水解呈碱性,滴定的指示剂应该选用酚酞。
(2)根据1分析所得该酸为一元弱酸,与等体积等浓度的氢氧化钠混合后,二者恰好完全反应生成盐溶液,水解呈碱性。所以溶液中存在的平衡有水解平衡和水的电离平衡,分别是Ac—+H2O  HAc+OH—、H2O
HAc+OH—、H2O H++OH- ,离子的浓度大小关系为c(Na+)>c(A-)> c(OH-) > c(H+)。
H++OH- ,离子的浓度大小关系为c(Na+)>c(A-)> c(OH-) > c(H+)。
(3)根据规律,酸碱抑制水的电离,水解盐促进水的电离,所以根据滴定顺序a、b、c三点对应的酸的浓度越来越小,所以对水的电离抑制程度越来越小,而d点为滴定终点之后碱过量的点,碱性较强对水的抑制程度大于a点,所以四点对应的水的电离的程度大小顺序为c>b>a>d。
(4)c点时溶液呈中性,c(H+)= c(OH—)=10-7mol/L、c(Na+) =c(Ac—)=10-4V,消耗氢氧化钠的体积为V,根据电离方程式HAc  Ac—+H+ 可得,酸的电离平衡常数K=" c(H+)" c(Ac-)/ c(HAc)= (10—7·V)/(20—V)。
Ac—+H+ 可得,酸的电离平衡常数K=" c(H+)" c(Ac-)/ c(HAc)= (10—7·V)/(20—V)。
考点:本题考查的是酸碱中和滴定实验。


科目:高中化学 来源: 题型:填空题
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题: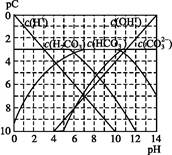
(1)在人体血液中,HC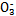 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC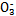 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC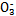 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值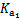 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1、c(C )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: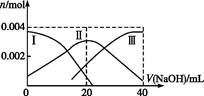
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
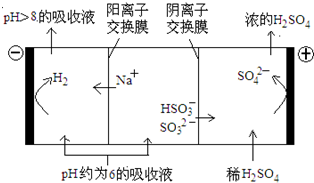
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: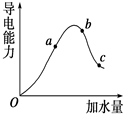
(1) “O”点为什么不导电________.
(2)a,b,c三点的pH由小到大的顺序是____________.
(3) a、b、c三点中电离程度最大的是
电离平衡常数Ka、Kb、Kc的大小关系为________.
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).
A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com