
| 浓度(molL-1) 时间(Min) |
0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| ||
| △ |
| ||
| △ |
| 3.4g |
| 17g/mol |
| c(N2)c(CO2) |
| c2(NO) |
| 0.36×0.36 |
| 0.482 |
| 9 |
| 16 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA |
| B、13g NO2和33g N2O4混合气体中含N原子数为NA |
| C、28g CO和22.4L N2含有的分子数均为NA |
| D、等物质的量的NH4+和OH-含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:


| hv |
查看答案和解析>>
科目:高中化学 来源: 题型:
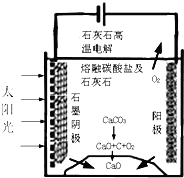 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
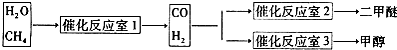

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别其他分散系本质特征是分散质微粒直径在lnm~100nm之间 |
| B、光线通过胶体时会产生丁达尔效应 |
| C、胶体是纯净物 |
| D、Fe(OH)3胶体能够使水中的悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com