
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
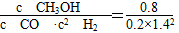 ≈2.041,故此时的温度为250 ℃。(2)将三个热化学方程式进行变形:[①+(-②)+4×③]×
≈2.041,故此时的温度为250 ℃。(2)将三个热化学方程式进行变形:[①+(-②)+4×③]×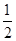 ,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×
,可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=[ΔH1+(-ΔH2)+4ΔH3]×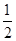 =-442.8 kJ·mol-1。
=-442.8 kJ·mol-1。

科目:高中化学 来源:不详 题型:单选题
 CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L
CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L 则Q1和Q2的关系为( )
则Q1和Q2的关系为( )| A.Q1<Q2 | B.Q1>Q2 | C.Q1=Q2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 =
= mol
mol
 =
= mol
mol
 =
= mol
mol

 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为 ;
)的大小关系为 ;
 和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1; H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1; H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
|
 (3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:| 实验编号 | 容器体积/L | 温度/°C |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1>Q2 | B.Q1=Q2 | C.Q1<Q2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1 |
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1 |
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1 |
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1 NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) ΔH1="-393.5" kJ/mol;
CO2(g) ΔH1="-393.5" kJ/mol; O2(g)
O2(g) H2O(g) ΔH2="-241.8" kJ/mol;
H2O(g) ΔH2="-241.8" kJ/mol; O2(g)
O2(g) CO2(g) ΔH3="-283.0" kJ/mol;
CO2(g) ΔH3="-283.0" kJ/mol; CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。  CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com