
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解时溶液中I-向阴极迁移 |
分析 A.根据电池反应式知,阳极上碘离子放电,则阳极为惰性电极;
B.电解时,阴极上氢离子放电,阳极上碘离子放电;
C.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产;
D.电解时溶液中阴离子向阳极移动.
解答 解:A.根据电池反应式知,阳极上碘离子放电生成碘酸根离子,则阳极应该为惰性电极石墨,阴极为铁,故A错误;
B.电解时,阴极上氢离子放电生成氢气,阳极上碘离子放电生成KIO3,电极反应为:I--6e-+3H2O=IO3-+6H+,故B正确;
C.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产碘酸钾,故C错误;
D.电解时溶液中I-向阳极移动,故D错误;
故选:B.
点评 本题考查了电解原理,根据电池反应式判断阴阳极材料、电极反应,并结合盐的性质分析解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 (Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.
(Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 除去氯化钠晶体中混有的氯化铵晶体 | 分离CCl4中的I2 | 分离酒精和水 | 除去CO气体中的CO2气体 |
| 装置 | 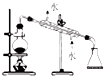 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| C. | 向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用结晶的方法分离氯化钠和硝酸钾的混合物 | |
| B. | 将液态物质加热至沸点,使之汽化,再重新冷凝为液体的操作过程称为蒸发 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 做焰色反应后,铂丝用稀硫酸洗涤,然后再放在火焰上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门具有创造性和实用性的科学 | |
| B. | 人们可以利用先进的技术和设备在化学反应中制造出新原子和新分子 | |
| C. | 制陶、冶金及酿酒过程中,肯定发生了化学变化 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子器件和分子机器等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com