
| A. | Na2O2可用作呼吸面具供氧剂,它还可以用于消毒、杀菌和漂白 | |
| B. | NaH可用于和水反应制取氢气,NaH是共价化合物 | |
| C. | Na2CO3的水溶液可用于油污的去除,其热溶液去污效果更好 | |
| D. | 侯氏制碱法,首先制取的是NaHCO3,NaHCO3受热分解生成碳酸钠 |
分析 A.过氧化钠可与二氧化碳反应生成氧气;
B.NaH为离子化合物;
C.加入促进碳酸钠的水解,溶液碱性增强;
D.侯氏制碱法反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,易分解.
解答 解:A.过氧化钠可与二氧化碳反应生成氧气,可用于制备氧气,具有强氧化性,可用于消毒、杀菌和漂白,故A正确;
B.NaH属于离子化合物,电子式为Na+[:H]-,故B错误;
C.加入促进碳酸钠的水解,溶液碱性增强,进而有利于油脂的水解,故C正确;
D.侯氏制碱法反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,易分解,可生成碳酸钠,故D正确.
故选B.
点评 本题综合考查钠的化合物等知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 28.4 g | B. | 28.4 mol | C. | 71 L | D. | 71 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
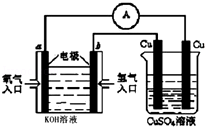 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| B. | 用热的纯碱溶液可区别植物油和矿物油 | |
| C. | 从溴水中提取溴可用植物油作萃取剂 | |
| D. | 生产盐酸和人造脂肪必须用氢气作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15k J |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达到平衡时,两个容器中XY3的物质的量浓度均为2mol/L | |
| C. | 容器②中反应达到平衡时吸收的热量为QkJ | |
| D. | 若容器①的体积为0.2L,则达到平衡时放出的热量大于23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 今年,中国女科学家屠呦呦获得诺贝尔奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )
今年,中国女科学家屠呦呦获得诺贝尔奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )| A. | 青蒿素与维生素C一样易溶于水工作 | |
| B. | 所有碳原子都可能在同一平面上 | |
| C. | 青蒿素晶体为分子晶体,其化学式为C15H22O5 | |
| D. | 含有酯基,在胃酸作用下能水解,其水解产物能使氯化铁溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应为Cd(OH)2+2e-═Cd+2OH - | |
| C. | 放电时电池内部OH-向正极移动 | |
| D. | 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com