
| A. | 32g O2所含的原子数目为2NA | |
| B. | 0.5NA个氯气分子的物质的量是0.5mol | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
分析 A、氧气由氧原子构成;
B、物质的量n=$\frac{N}{{N}_{A}}$;
C、根据每个CH4、H2O分子含有10个电子,在标准状况下,22.4L CH4与18g H2O的物质的量都是1mol计算;
D、没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算一氧化碳的物质的量.
解答 解:A、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,即2NA个,故A正确;
B、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故B正确;
C、每个CH4、H2O分子含有10个电子,在标准状况下,22.4L CH4与18g H2O的物质的量都是1mol,所含有电子数均为10NA,故C正确;
D、不是标准状况下,不能使用标况下的气体摩尔体积计算22.4LCO的物质的量,故D错误;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 分别向2.0mL 0.1mol/LCH3COOH溶液和2.0mL 0.1mol/LH3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 在酒精灯上分别加热打磨和未打磨的铝箔,现象都是铝箔熔化不滴落 | 铝能被氧气氧化成氧化铝 且熔点:氧化铝>铝 |
| C | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中,观察到品红溶液褪色,试管中产生蓝色溶液 | 浓硫酸具有强氧化性 |
| D | 向漂白粉中加入较浓的盐酸,并将湿润的淀粉碘化钾试纸置于试管口,观察到产生气泡,试纸未变蓝 | 漂白粉已经失效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中,参加反应的各物质的质量比等于其物质的量比 | |
| B. | 化学的特征就是认识分子和制造分子 | |
| C. | 俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础 | |
| D. | 大量使用塑料袋造成白色污染,最佳处理措施是就地焚烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和H3属于同位素 | B. | O2和O4属于同素异形体 | ||
| C. | C60晶体是原子晶体 | D. | N5+中含有36个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO、CO2都是酸性氧化物 | B. | BaSO4、Ca(OH)2、KNO3溶液都是电解质 | ||
| C. | 纯碱、烧碱、碱石灰都是碱 | D. | 稀豆浆、牛奶、淀粉溶液都是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
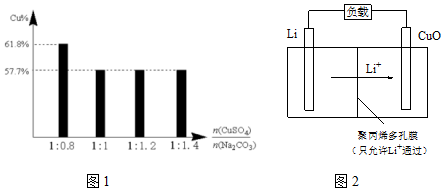
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com