
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
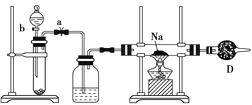
A B C
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”“不漏气”或“无法确定”),判断理由是__________________________。
(2)写出A装置中反应的化学方程式_______________________。
(3)B装置中盛放的试剂是____________,其作用是________________;
D装置中盛放的试剂是_______,作用是_________________________。
(4)C装置中观察到的现象是____________________________________。
【答案】漏气 漏斗中的液体能全部流入试管说明试管中压强与外界相同 2 Na2O2+2H2O ===4NaOH+O2↑ 浓硫酸 除去O2中的水蒸气 碱石灰 防止空气中的H2O、CO2进入C 剧烈燃烧,发出黄光,有淡黄色物质生成
【解析】
A装置是过氧化钠与水制备氧气的发生装置,B中是除去氧气中的水蒸气,将得到的干燥的氧气通入盛有钠的硬质玻璃管中燃烧,D球形干燥管则是防止外界空气中的H2O、CO2进入硬质玻璃管,干扰试验,据此分析作答。
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管,说明装置漏气,因为漏斗中的液体能全部流入试管,说明试管中压强与外界相同,故答案为:漏气;漏斗中的液体能全部流入试管说明试管中压强与外界相同;
(2)A装置中反应是过氧化钠和水的反应,反应的化学方程式为2Na2O2+2H2O====4NaOH+O2↑;
(3)浓硫酸可干燥氧气,故B中盛放的是浓硫酸,其作用是除去O2中的水蒸气,故答案为:浓硫酸;除去O2中的水蒸气;
(4)为避免空气中的二氧化碳和水蒸气进入C装置与钠反应,影响实验现象的判断,干燥管中应装碱石灰,故答案为:碱石灰;防止空气中的H2O、CO2进入C;
(5)C装置中观察到的现象是钠在氧气中燃烧的实验现象,钠剧烈燃烧,发出黄光,有淡黄色物质生成。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl-
B. 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO![]()
C. 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )
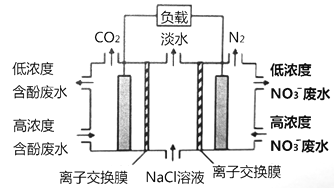
A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池的示意图,下列说法错误的是
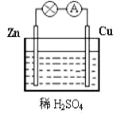
A. 一段时间后,锌片逐渐溶解,质量减小
B. 该装置能将电能转化为化学能
C. 将铜片换成石墨棒,灯泡亮度不变
D. 铜不参与氧化还原反应,只起导电作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
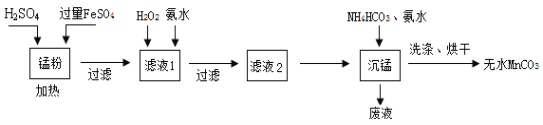
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于盐类水解反应的是
A. Na2CO3溶液:CO32- + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. NaHCO3溶液:HCO3- + H2O ![]() CO32- + H3O+
CO32- + H3O+
C. NaHS溶液:HS- + H2O ![]() H2S + OH-
H2S + OH-
D. KF溶液:F- + H2O = HF + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
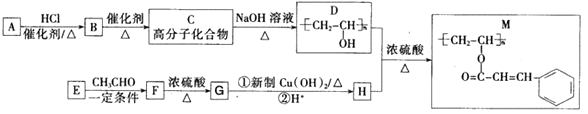
已知:

请回答:
(1)B的化学名称为_______________;M中含氧官能团的名称为_______________;F→G的反应类型为____________________。
(2)C→D的化学反应方程式为_________________________________________。
(3)E的结构简式为_______________;H的顺式结构简式为___________________。
(4)同时满足下列条件的F的同分异构体有_________种(不考虑立体异构):①属于芳香族化合物;②能发生水解反应和银镜反应。写出其中一种核磁共振氢谱有4种吸收峰,其峰面积之比为6:2:1:1的物质的结构简式_________。
(5)参照上述合成路线和相关信息,以乙烯和乙醛为原料(无机试剂任选)合成有机物![]() , 设计合成路线_____________。
, 设计合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com