
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
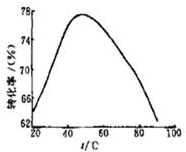
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的分子量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA | |
| B. | 标况下,22.4L SO3含有NA个H2O分子 | |
| C. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| D. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.48 | B. | 3.78 | C. | 10.52 | D. | 10.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol的A2,同时生成n mol的AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol的AB同时生成n mol的B2 | |
| D. | 平均相对分子质量不随时间变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com