(i)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.
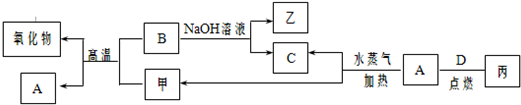
甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如图所示:
请回答下列问题:
(1)B与甲反应的化学方程式是
.
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(填“是”或“否”).
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
.
(4)写出A与水蒸气反应生成C和甲的化学方程式
.
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
,混合物中B的物质的量为
mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
mol,混合物中A的质量为
g(用含字母的分数式表示).
(ii)
(一)选择除去下列各组物质中的杂质(括号内物质为杂质)的试剂和方法,填于表:
|
乙醇(乙酸) |
乙烯(二氧化硫) |
乙酸乙酯(乙醇) |
| 加入试剂 |
|
|
|
| 分离方法 |
|
|
|
(二)氯乙烯是合成聚氯乙烯的单体.裂解法生产氯乙烯的方法如下图所示:

按要求回答下列问题:
(1)A的分子式为
.
(2)从绿色化学角度考虑,裂解法的优点是
.
(3)1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH
2CH
2OH),请写出该反应的化学方程式:
.
(4)焚烧废旧塑料过程中会排放有毒物质.写出聚氯乙烯塑料完全燃烧的化学方程式:
.



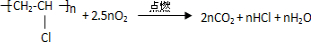 ,
,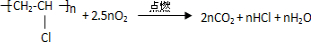 .
.


 .请写出有机化合物A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:
.请写出有机化合物A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式:

